常温下,向盛有100.0g KOH溶液的烧杯中逐滴加入120.0g质量分数为7.3%的稀盐酸,用pH计(精确测定溶液pH的仪器)测定反应过程中溶液的pH,所得数据如表:
| 加入稀盐酸的质量/g |
60.0 |
80.0 |
100.0 |
120.0 |
| 烧杯中溶液的pH |
13.7 |
13.3 |
7.0 |
0.7 |
(1)恰好完全反应时,消耗稀盐酸的质量为 g。
(2)求该KOH溶液中溶质的质量分数(结果精确到0.1%)。
现有一包由2.4g镁、6.5g锌、1.6g碳混合而成的粉末,把它加入到一定量的硝酸银溶液中,反应结束后,经过滤、洗涤、干燥,测得滤渣含有三种物质。则滤渣的质量可能是( )
A.10.5gB.35.6gC.44.8gD.45.8g
向盛一定质量铁粉的烧杯中逐滴加入稀硫酸充分反应,产生气体质量与所加稀硫酸质量的关系如图所示。请根据该图信息计算:
(1)铁粉反应完时,产生氢气的质量为 g。
(2)原稀硫酸中溶质的质量分数(写出计算过程)。

二氧化氯(ClO2)是安全消毒剂,杀菌能力优于Cl2,可由NaClO2与Cl2反应制得。
(1)配平化学方程式: NaClO2+ Cl2═ ClO2+ NaCl。
(2)71g Cl2完全反应,理论上最多生成ClO2的质量为 g。
为了探究氢氧化钡溶液和硫酸钠溶液反应后所得滤液X的成分,同学们做了以下实验:取50克滤液于烧杯中,先向烧杯中滴加溶质质量分数为6%的硫酸镁溶液20克,接着向烧杯中滴加稀硫酸。加入溶液的质量与烧杯内沉淀的质量关系如图所示。
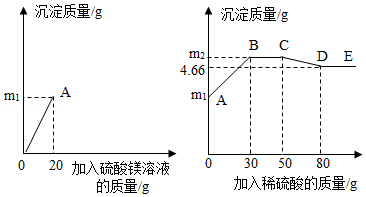
(1)滤液X的pH 7(选填"大于"、"等于"或"小于")
(2)CD段发生反应的化学方程式为 。
(3)滤液X中含有的溶质是 。
(4)滴加入30克稀硫酸时,烧杯中沉淀的质量m 2的值为多少?(写出计算过程)
将质量均为10克的Mg、Fe、Zn三种金属分别放入质量和溶质质量分数均相同的三份稀硫酸中,反应完成后,生成氢气的质量关系不可能的是( )
A. B.
B. 
C. D.
D.
氧化铜与稀盐酸发生反应时,容器中溶液总质量随时间的变化曲线如图所示。下列说法错误的是( )

A.该实验是将稀盐酸逐渐加入到盛有氧化铜的容器中
B.m点表示氧化铜与稀盐酸恰好完全反应
C.m点和n点对应溶液中铜元素的质量不相等
D.m点和n点对应溶液蒸发结晶后得到的固体成分相同
下列图象不能正确反应对应关系的是( )
A.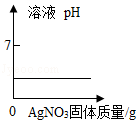 向盐酸溶液中加入少量AgNO3固体(忽略溶液体积变化)
向盐酸溶液中加入少量AgNO3固体(忽略溶液体积变化)
B.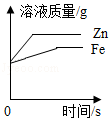 将形状相同质量相等的铁和锌分别加入到足量的质量和浓度都相等的稀硫酸中
将形状相同质量相等的铁和锌分别加入到足量的质量和浓度都相等的稀硫酸中
C. 加热KClO3(加入少量MnO2)固体混合物制取O2
加热KClO3(加入少量MnO2)固体混合物制取O2
D. 向饱和石灰水中加入少量生石灰
向饱和石灰水中加入少量生石灰
将质量相等的镁粉和铁粉分别投入等质量等浓度的稀硫酸中,所得H2质量与稀硫酸质量关系曲线正确的是( )
A.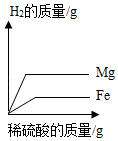 B.
B.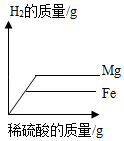
C. D.
D.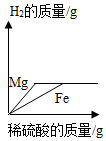
水污染与防治是当今人类需要关注的环境问题之一,工农业废水和生活污水是水污染的主要来源。回答下列问题:
(1)酸雨 (填“能”或“不能”)污染水体,煤燃烧产生SO2,SO2形成酸雨的主要原因是 。
(2)废旧电池中含有的汞、镉等重金属会污染水体,造成生物体中毒,其原因是重金属能使生物体内的 (填化学物质)结构破坏,失去生理活性。
(3)某工业废水含HgSO4,可通过铁网而将汞留下,加热将汞形成蒸气回收利用。其反应的化学方程式为 ,汞的沸点 (填“低于”或“高于”)铁的沸点。也可以向废水中加入Na2S溶液形成沉淀而除去汞,该沉淀的化学式为 。
(4)甲厂污水含硫酸的质量分数为0.98%,其流速为45kg/s,乙厂污水含烧碱的质量分数为0.4%,为排放达标,现将两厂的污水混合处理,反应的化学方程式为 ,则乙厂污水的最佳流速为 kg/s。
下列图示,能正确反映化学反应原理的是( )
A.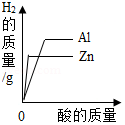 等质量的铝和锌与等质量分数、足量的稀硫酸反应
等质量的铝和锌与等质量分数、足量的稀硫酸反应
B. 向氢氧化钠溶液中滴加水
向氢氧化钠溶液中滴加水
C.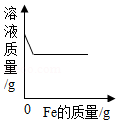 向硫酸铜溶液中加入适量的铁粉
向硫酸铜溶液中加入适量的铁粉
D. 在密闭容器中一定质量的碳粉与足量氧气充分燃烧
在密闭容器中一定质量的碳粉与足量氧气充分燃烧
下列图象能正确反映其对应关系的是( )
A.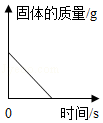 高温煅烧一定质量的碳酸钙固体
高温煅烧一定质量的碳酸钙固体
B.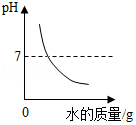 表示向NaOH溶液中不断加水稀释
表示向NaOH溶液中不断加水稀释
C.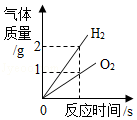 表示水电解生成氢气与氧气的质量关系
表示水电解生成氢气与氧气的质量关系
D.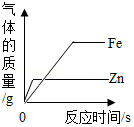 表示分别向等质量的铁粉、锌粉中加入足量的质量分数相同的稀盐酸
表示分别向等质量的铁粉、锌粉中加入足量的质量分数相同的稀盐酸
某NaCl样品中混有杂质BaCl2,为测定样品中BaCl2的质量分数,取固体样品10.0克完全溶解于水中,并向其中逐滴加入稀硫酸,实验过程中,产生沉淀的质量与加入稀硫酸的质量关系如图所示
(1)沉淀的化学式 。
(2)计算样品中BaCl2的质量分数(写出计算过程)

向碳酸钠溶液中逐滴滴加稀盐酸至过量,该溶液中依次发生的反应如下:①Na2CO3+HCl=NaHCO3+NaCl;②NaHCO3+HCl=NaCl+H2O+CO2↑;向碳酸钠和碳酸氢钠的混合溶液中逐滴滴加稀盐酸,所产生二氧化碳的质量与所加盐酸的质量图象关系正确的是( )
A. B.
B.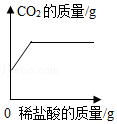
C.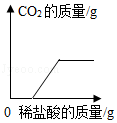 D.
D.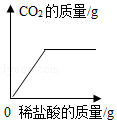
试题篮
()