碳酸氢钠是面点膨松剂的主要成分之一。
小芳同学研究反应2NaHCO3+H2SO4═Na2SO4+2H2O+2CO2↑中NaHCO3与CO2之间量的关系。
(1)理论计算:1.26g NaHCO3粉末与足量稀硫酸反应,计算生成CO2的质量(写出计算过程)。
(2)实验分析:小芳用右图装置进行实验,向盛有足量稀硫酸的锥形瓶中加入1.26g NaHCO3粉末,完全反应至不再产生气泡。称取反应前后质量如下表,发现反应前后质量变化值 (填“大于”、“小于”或“等于”)生成CO2质量的理论值,原因可能是 。
反应前 |
反应后 |
|
NaHCO3/g |
锥形瓶+稀硫酸/g |
锥形瓶+反应后溶液/g |
1.26 |
24.59 |
25.36 |
用久的热水瓶内胆有一层水垢【主要成分是CaCO3和Mg(OH)2】。兴趣小组为了解具体成分进行了实验。他们取样品25克放入质量为100克的锥形瓶中,置于电子天平上,往瓶内加入150克稀盐酸时,恰好完全反应(样品中的杂质不与稀盐酸反应),此时天平示数如图。对所得混合物进行过滤、洗涤、干燥、称量,得到固体4.2克。请回答下列问题:
(1)恰好完全反应时,溶液中的溶质为 (填化学式)。
(2)样品中CaCO 3的质量分数是多少?
(3)反应结束时溶液中MgCl 2的质量分数是多少?(精确到0.1%)。

如图表示某国际空间站的水气整合系统,其中“氧气生成系统”能电解水,产生氢气和氧气;“萨巴蒂尔系统”能把氢气和航天员呼吸产生的二氧化碳反应生成液态水和甲烷气体;液态水即时循环利用,甲烷排放到外太空。
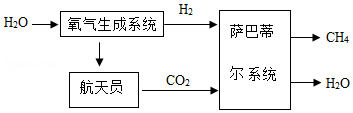
(1)图中化学式标注的物质,属于有机物的是 。
(2)已知一个航天员平均一天要消耗约0.8千克的氧气,请计算一个航天员在空间站30天,理论上至少需要给该水气整合系统补充多少质量的水?(已知二氧化碳足量)
小科为测定某石灰石样品(主要成分为碳酸钙,其它成分不与稀盐酸反应)中碳酸钙的含量,利用气密性良好的图甲装置进行实验:①称取石灰石样品6克,加入锥形瓶中,塞紧瓶塞,从左侧持续缓慢鼓入空气;②一段时间后打开分液漏斗活塞,注入足量的稀盐酸,开始计时;③待装置D总质量不再增加时停止鼓入空气。实验过程中测得装置D增加的质量随时间变化图象如图乙。(碱石灰能吸收二氧化碳和水) 
(1)根据图乙,运用化学方程式计算该石灰石样品中碳酸钙的质量分数。(计算结果精确到0.1%)
(2)下列情况中,会导致测得的碳酸钙质量分数偏大的是 。
①去掉装置A,将空气直接鼓入装置B
②去掉装置C,将B与D装置直接相连
③当气泡停止产生时立即停止鼓入空气
实验室有一份在空气中潮解变质的氢氧化钠样品,质量为1.5g某实验小组将这份样品完全溶解,配成50g溶液,然后缓慢滴入7.3%的稀盐酸,同时进行搅拌,使二氧化碳全部逸出。滴加过程中,多次测得溶液pH和溶液总质量,部分数据如下表所示:
| 测量次数 |
第1次 |
第6次 |
第16次 |
第21次 |
第26次 |
| 滴加的盐酸总质量/g |
0 |
5 |
15 |
20 |
25 |
| 溶液总质量/g |
50 |
55 |
m |
69.78 |
74.78 |
| 溶液pH |
12.4 |
12.1 |
7.0 |
2.2 |
2.1 |
请分析计算:
(1)第 次测量时,溶液中只有一种溶质。
(2)表中m= 。
(3)样品中碳酸钠的质量分数。(计算结果精确到0.1%)
(4)1.5g样品中氢氧化钠固体的质量。
实验室里有一瓶氢氧化钙粉末由于较长时间敞口放置,已部分变质为碳酸钙。某课外兴趣小组为测定该瓶粉末中碳酸钙的质量分数,进行实验操作、数据收集和计算。
(1)配制稀盐酸:配制500克7.3%的稀盐酸,需要36.5%的浓盐酸 克。
(2)抽样测定:将瓶中粉末搅拌均匀后称取20克样品放入烧杯并置于电子秤上,再加入足量稀盐酸充分反应,总质量与反应时间的关系如下表所示:
| 反应时间/秒 |
0 |
10 |
20 |
30 |
40 |
| 总质量/克 |
310.0 |
309.6 |
308.6 |
307.8 |
307.8 |
完全反应后,生成的CO 2气体的质量为 克
(3)计算出该样品中CaCO 3的质量分数(要有计算过程)。
(4)经过分析讨论,同学们觉得这样测得的结果有可能偏大,原因是 (指出一点即可)
工业合成氨的相关反应式为:N2+3H2 2NH3
(1)合成氨的原料气中可以通过分离空气直接得到的是 。
(2)当前,原料气H2可用天然气来制取,理论上每生产1吨H2会同时产生5.5吨CO2,有科学家正在研究一种不生成CO2的新方法来制取原料气H2.若需要合成8.5万吨氨,改用新方法制取原料气H2可以减少排放多少万吨CO2?
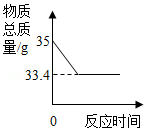
实验室用34克过氧化氢溶液和1克二氧化锰制取氧气,实验的相关数据如图。请回答:
(1)二氧化锰作为催化剂在化学反应前后本身的 都没有发生变化。
(2)反应生成氧气的质量为 g。
(3)计算过氧化氢溶液中溶质的质量分数。(此问必须要有计算过程)
实验室有一瓶久置的氢氧化钠固体,经检验只含有NaOH和Na2CO3两种物质。现取该固体样品12.5g溶于水配制成溶液。然后向溶液中滴加稀硫酸,同时收集反应产生的气体。当溶液中的溶质恰好全部转化成Na2SO4时,立即停止滴加稀硫酸。将产生的气体干燥后测定其质量为2.2g(假定溶液中无气体残留)。回答下列有关问题:
(1)写出碳酸钠与硫酸反应的化学方程式: 。
(2)氢氧化钠固体样品中NaOH的质量为 。
(3)计算所加稀硫酸的体积(稀硫酸的溶质质量分数为40%,密度为1.3g/cm3)。
[要求:第(3)小题写出计算过程且计算结果保留到小数点后1位]
洁厕灵是常用的陶瓷清洗液,某同学对某品牌洁厕灵的有效成分含量进行探究。向一锥形瓶中加入100g该品牌的洁厕灵,再加入足量的溶质质量分数为8%的NaHCO3溶液120g,反应结束后溶液的总质量是215.6g。试计算下列问题:
[知识卡片]洁厕灵有效成分是HCl,洁厕灵中其它成分均不跟NaHCO3反应。
(1)产生的二氧化碳质量为 克。
(2)该品牌洁厕灵中HCl的质量分数是多少?(写出计算过程。)
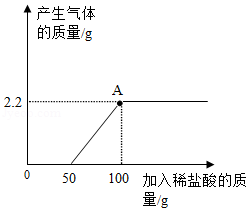
向部分变质的NaOH溶液中逐滴滴加稀盐酸,产生气体质量与所加稀盐酸质量关系如图所示:
(1)完全反应后,产生气体的质量是 g。
(2)当滴加稀盐酸至图中A点时,溶液中含有的溶质是 。
(3)计算所加稀盐酸中溶质的质量分数。(写出规范的计算过程)。
电解法是工业上制铜的主要方法:控制一定条件,电解硫酸铜溶液,析出的铜附着在阴极板上,化学方程式为:2CuSO 4+2H 2O  2Cu↓+O 2↑+2H 2SO 4.取一定质量的硫酸铜溶液,在实验室中模拟工业条件进行电解,当硫酸铜恰好完全反应时,得到488.0g溶液和9.6gCu.(注:本题不考虑气体在溶液中的溶解)
2Cu↓+O 2↑+2H 2SO 4.取一定质量的硫酸铜溶液,在实验室中模拟工业条件进行电解,当硫酸铜恰好完全反应时,得到488.0g溶液和9.6gCu.(注:本题不考虑气体在溶液中的溶解)
回答下列问题:
(1)原硫酸铜溶液中溶质的质量分数是多少?(写出解题过程)
(2)向电解后得到的488.0g溶液中加入一定量的某种物质,充分反应后,所得溶液的质量、溶质质量分数均与原硫酸铜溶液相同。则这种物质可能是下列物质中的 (填选项编号)
A.Cu B.CuO C.Cu(OH) 2D.CuCO 3
某化肥厂生产的一种化肥包装袋上的说明如图所示,化学兴趣小组为测定其纯度,取样品5.6克,完全溶于水,向所得溶液中加入100克一定溶质质量分数的硝酸银溶液,恰好完全反应生成14.35克沉淀(杂质不与硝酸银溶液反应)。通过计算回答。
(1)所用硝酸银溶液的溶质质量分数;
(2)该化肥是否合格(结果精确到0.1%)。

向一定质量的酸性CuSO 4溶液(含少量H 2SO 4)中逐滴加入NaOH溶液,产生沉淀的质量与所加入NaOH溶液的质量关系如图所示。
(1)当加入NaOH溶液的质量为30g时,溶液中的溶质是 (化学式)。
(2)计算所加NaOH溶液的溶质质量分数。

酸奶作为世界公认的长寿食品之一正愈来愈受到人们的重视和喜爱。酸奶中的酸味来自乳酸(化学式为C3H6O3)。
(1)酸奶主要提供人类营养物质中的哪一类? 。乳酸在人体内可被完全氧化为CO2和H2O,1.8 g乳酸完全氧化消耗O2的质量为 g。
(2)为了测定某品牌酸奶中乳酸的含量,振华同学取100 mL酸奶和100 mL蒸馏水于烧杯中,慢慢滴入0.4%的 NaOH溶液并不断搅拌,用传感器测得溶液pH随加入NaOH溶液体积V的变化关系如图所示。计算该酸奶中乳酸的含量为多少克每升。
(已知:乳酸的钠盐可表示为CH3CH(OH)COONa,测定所用NaOH溶液的密度为1.0 g/mL,计算结果精确到0.01,无计算过程不给分)。

试题篮
()