合金是重要的金属材料,常用来制造机械零件、仪表和日用品。某化学研究小组利用黄铜(铜、锌合金)进行了如图所示实验:
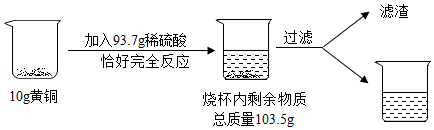
请计算:
(1)生成氢气的质量为 g,黄铜中锌的质量为 g;
(2)过滤后所得溶液的溶质质量分数。
北宋沈括编撰的《梦溪笔谈》中,记录了用CuSO4溶液熬制胆矾的铁釜,使用时间久了也可以化作铜。
(1)由上述材料分析,Fe比Cu的金属活动性 (填“强”或“弱”)。
(2)如果向足量的CuSO4溶液中加入5.6g Fe粉,充分反应后,理论上可以得到Cu的质量是多少?
酸、碱、盐种类繁多,与人类日常生活和工农业生产关系十分密切。
(1)酸具有相似的性质,因为不同的酸在水溶液中都能解离出 (填字母)。
a.H2O b.H2 c.H+ d.OH﹣
(2)检验敞口放置的氢氧化钠溶液是否变质,可以选用的一种试剂是 。
(3)利用数字化实验设备,测定盐酸与氢氧化钠溶液反应时溶液pH变化,实验结果如图1,当滴入溶液为V2mL时,所得溶液中溶质的化学式为 ,所得溶液能使紫色石蕊溶液变成 色。
(4)氯化钠是生活中常见的盐。为除去某粗盐水中的MgSO4、CaCl2杂质,得到NaCl溶液,某化学小组设计了如图2实验方案:
①过滤操作中所用到的玻璃仪器有烧杯、漏斗和 。
②以上方案中有关反应的化学方程式为 (写一个即可)。
③写出溶液乙中含有的杂质,并将以上方案补充完整
。
(5)某实验室用20%的NaOH溶液洗涤一定量石油产品中残余的H2SO4,消耗NaOH溶液40g,洗涤后的溶液呈中性,请计算该一定量石油产品中H2SO4的质量。
某小组用粗锌测定某稀硫酸中溶质的质量分数。取一定质量的稀硫酸于烧杯中,称量稀硫酸和烧杯的总质量;然后,向其中分两次加入粗锌(杂质不参加反应),实验过程和数据如图所示。请计算:
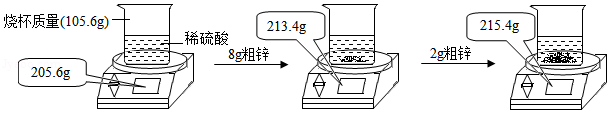
(1)生成氢气的总质量为 g。
(2)稀硫酸中溶质的质量分数。
湿法炼铜为我国首创。早在西汉时期,就有从胆矾水溶液中置换出铜的记载,其反应的化学方程式为:Fe+CuSO4═Cu+FeSO4.若采用此法炼制128t铜,需要消耗铁的质量是多少?
铜粉中混有少量的铁粉,为了除去铁粉,某校兴趣小组同学,取该铜粉20g于烧杯中,然后等量分5次加入未知质量分数的某强酸(W)溶液,充分反应后所得数据如下表,请根据相关知识和图表信息回答下列问题。
项目 |
第1次 |
第2次 |
第3次 |
第4次 |
第5次 |
加入W溶液的质量/g |
5 |
5 |
5 |
5 |
5 |
每次产生气体的质量/g |
0.01 |
0.01 |
0.01 |
0.005 |
0 |
(1)写出你所选择酸(W)的化学式 。
(2)铜粉中混有铁粉的质量是 。
(3)计算你选择酸(W)的质量分数(写出计算过程)。
实验室用68g过氧化氢溶液和2g二氧化锰制取氧气,实验中非气态物质的总质量随时间变化如图所示。回答下列问题:
(1)反应中二氧化锰的作用是 。
(2)计算过氧化氢溶液中溶质的质量分数。(写出计算过程)

欲测定一瓶标签破损的稀硫酸的溶质质量分数,现取30g稀硫酸样品于烧杯中,将15%的NaOH溶液逐滴加入烧杯中,边加边搅拌,随着NaOH溶液的不断加入,溶液pH的变化如图所示。回答下列问题:
(1)a点溶液中的溶质是 (填化学式)。
(2)计算该稀硫酸的溶质质量分数。(写出计算过程,结果精确到0.1%)

学习化学后,小红同学知道了鸡蛋壳的主要成分是碳酸钙。为了测定鸡蛋壳中碳酸钙的质量分数,她收集了干燥的鸡蛋壳拿去实验室,与足量稀盐酸在烧杯中反应(杂质不与盐酸反应)。有关实验数据如下表:
反应前 |
反应后 |
|
烧杯和稀盐酸总质量 |
鸡蛋壳的质量 |
烧杯和剩余物总质量 |
150g |
6.25g |
154.05g |
(1)反应生成CO2的质量为 g。
(2)请你帮助小红同学计算她收集的鸡蛋壳中碳酸钙的质量分数。(写出计算过程)
欲测定一瓶标签破损的硫酸铜溶液的溶质质量分数,现取50g硫酸铜溶液样品于烧杯中,逐滴加入10%的NaOH溶液。生成沉淀的质量与加入NaOH溶液的质量之间的关系如图所示。回答下列问题:
(1)图中x= 。
(2)计算硫酸铜溶液的溶质质量分数。(写出计算过程)

我市覃塘区石灰石资源丰富,某石灰厂为了测定某石灰石样品中CaCO3的质量分数,往盛有300g稀盐酸的烧杯中依次加入粉碎后的石灰石样品(杂质不与盐酸反应),充分反应后,实验数据记录如表:
实验次数 |
第一次 |
第二次 |
第三次 |
石灰石样品/g |
25 |
15 |
10 |
烧杯中物质总质量/g |
316.2 |
326.8 |
m |
请回答:
(1)CaCO3中钙、碳、氧三种元素的质量比为 ;(写最简比)
(2)表中m= ;
(3)所用稀盐酸的溶质质量分数为 ;
(4)求该石灰石样品中CaCO3的质量分数。(写出计算过程)
试题篮
()