在实验室中,某同学发现了一瓶敞口放置的氢氧化钙粉末试剂,并对其产生兴趣,进行如下实验。

根据实验过程和图象提供的信息,回答下列问题:
(1)完全反应后生成气体的质量是 g。
(2)b点溶液中的溶质为 (填名称)。
(3)求恰好完全反应时所得溶液中溶质的质量分数?(利用化学方程式进行计算,书写计算过程,结果精确到0.1%)
取100g溶质的质量分数为5.3%的Na 2CO 3溶液,然后按如图进行实验.

(1)恰好完全反应时产生沉淀质量是 g;
(2)恰好完全反应后将烧杯内的物质过滤.计算所得滤液中溶质的质量分数(计算结果保留至0.1%).
向盛有193.8g硫酸铜溶液的烧杯中,逐滴加入质量分数为8%的氧氧化钠溶液,反应过程中生成沉淀的质量与所用氧氧化钠溶液的质量关系如图所示。
(化学方程式为 CuSO 4+2NaOH=Cu(OH) 2↓+Na 2SO 4)
请计算:
(1)恰好完全反应时生成沉淀的质量。
(2)恰好完全反应时溶液中溶质的质量分数。

氯化钙钾石的化学式为KCl•xCaCl 2(x是CaCl 2的系数).它是一种天然的钾肥,溶于水后得到KCl和CaCl 2的混合溶液.某化学兴趣小组为了测定氯化钙钾石中钾元素的质量分数,称取样品18.55g加水完全溶解,得到KCl和CaCl 2的混合溶液.向该溶液中逐滴加入Na 2CO 3溶液,发生反应的化学方程式为:Na 2CO 3+CaCl 2═CaCO 3↓+2NaCl,产生的沉淀与加入Na 2CO 3溶液的质量关系如图所示.请回答下列问题:
(1)图中AB段表示的意义是 .
(2)①样品中CaCl 2的质量是多少?
②所用Na 2CO 3溶液中溶质的质量分数是多少?
(3)①样品中钾元素的质量分数是多少?(精确到0.1%)
②氯化钙钾石化学式中的x值是多少?
【要求:(2)、(3)两问写出计算过程】

实验室有一瓶敞口放置一段时间的氢氧化钠固体,为测定这瓶样品中氢氧化钠的质量分数,做如下实验。现取瓶中17.3g样品溶于足量的水中,向所得溶液中逐滴加入200g一定溶质质量分数的稀盐酸。实验过程如图所示,试计算:
(1)恰好完全反应时,产生气体的质量是 g。
(2)所加稀盐酸中的溶质的质量分数是多少?
(3)样品中氢氧化钠的质量分数是多少?(结果保留一位小数)

向盛有26.4g硫酸钠和碳酸钠混合物的烧杯中加入218g稀硫酸,恰好完全反应,固体全部消失,烧杯内物质总质量减少了4.4g。(化学反应方程式为Na 2CO 3+H 2SO 4═Na 2SO 4+H 2O+CO 2↑),请计算:
(1)原混合物中碳酸钠的质量。
(2)反应后所得溶液中溶质的质量分数。
向含10g NaOH的溶液中通入一定量的CO 2,然后在低压条件下蒸干得12.6g白色固体,通过计算确定该白色固体的成分 (写出计算过程)。
【查阅资料】
1、Na 2CO 3+CO 2+H 2O═2NaHCO 3
2、NaHCO 3溶液在低压蒸干条件下得到的固体不分解。
小王同学想测定某Cu﹣Zn合金中铜的质量分数,取合金粉末13g,向其中逐渐加入一定溶质质量分数的稀硫酸,所加稀硫酸与生成氢气的质量关系如图所示。请完成下列分析及计算:
(1)反应生成氢气的总质量为 g。
(2)计算合金中铜的质量分数。

实验室中发现一瓶因长期放置而被氧化的铝粉。取6.0克铝粉样品,将100克稀硫酸逐滴加入其中,固体质量随加入硫酸溶液质量的变化情况如图所示,实验过程中测得产生氢气0.1克。请计算:
(1)样品中铝单质的质量。(写出计算过程)。
(2)硫酸溶液的溶质质量分数为 。

根据图示的实验过程和所提供的数据(反应在常温下进行)进行计算。

(1)生成沉淀的质量是多少克?
(2)计算NaOH溶液的溶质质量分数。
某兴趣小组为测定石灰石中碳酸钙的质量分数,取12g石灰石样品加入烧杯中,将120g稀盐酸平均分四次加入,充分反应后(杂质不溶于水也不与稀盐酸反应),测得实验数据如下:
| 实验次数 |
第一次 |
第二次 |
第三次 |
第四次 |
| 加入稀盐酸的质量/g |
30 |
30 |
30 |
30 |
| 剩余固体的质量/g |
9 |
6 |
3 |
2 |
分析数据计算(结果精确到0.1%):
(1)该样品中碳酸钙的质量分数。
(2)所用稀盐酸的溶质质量分数。
(3)12g样品中的碳酸钙恰好完全反应时所得溶液的溶质质量分数。
某钢厂实验室为测定赤铁矿中Fe 2O 3的含量,将矿石粉碎(其中杂质既不溶于水也不与酸反应),进行如下实验:

请回答下列问题:
(1)该赤铁矿石中Fe 2O 3的质量分数为 。
(2)该钢厂用上述赤铁矿石1900吨来生产生铁,则理论上能生产含杂质5%的生铁质量为多少吨。
(3)求上述所用稀硫酸的溶质质量分数。
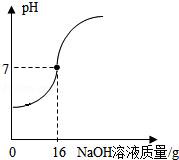
某课外小组的同学用10% 的氢氧化钠溶液逐滴加入到50克稀盐酸中,边加热边搅拌,随着氢氧化钠溶液的不断加入,溶液的pH变化情况如图所示。
(1)计算当pH=7时,所得溶液的溶质质量分数。
(2)若将pH=7时所得溶液的溶质质量分数增大一倍,可采用的一种方法是 ,写出计算过程(最后结果精确到0.1)
"黄铜"是铜锌合金,比纯铜耐腐蚀,街头许多"金色"饰品就是用它来制作的。现取某种黄铜10g投入到154.7g某浓度稀硫酸中,恰好完全反应后生成的溶液和残余固体总质量为164.5g,计算:
(1)产生氢气的质量是多少克?
(2)这种黄铜中铜的质量是多少克?
(3)所得溶液的溶质质量分数是多少?
试题篮
()