根据《羊城晚报》报道:今年8月,有十几个民工饮用散装酒后双目失明,继而死亡。据调查,散装酒中含有超标的有毒物质甲醇,其化学式为:CHXO,求:
(1)已知甲醇的相对分子质量为32,则X为 ;
(2)甲醇完全燃烧时,生成二氧化碳和水,发生如下反应:2CHXO + 3O2 CO2+4H2O
CO2+4H2O
则生成二氧化碳和水的质量比为 。
(3)如果甲醇在氧气中不完全燃烧可发生如下反应:8CHXO + nO2 mCO2+2CO+16H2O
mCO2+2CO+16H2O
若反应生成3.6g水,请计算:
①m值是 ;
②参加反应的氧气质量是多少克?(写出规范步骤并计算)
实验室有一瓶未知浓度的BaCl2溶液,某同学取出150g该溶液于烧杯中,向其中逐滴加入溶质质量分数为26.5%的Na2CO3溶液。反应过程中生成沉淀的质量与所用Na2CO3溶液质量的关系如图甲所示。已知:BaCl2+Na2CO3=BaCO3↓+2NaCl 请计算:
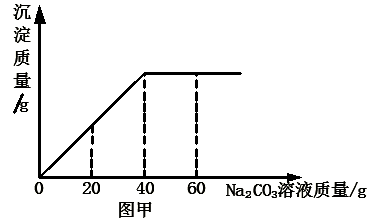
(1)配制26.5%的Na2CO3溶液80g,需要Na2CO3固体 g。
(2)BaCl2溶液的溶质质量分数是多少?(写出计算过程,结果保留到0.1%)
把12.5g的大理石放入盛有34.4g稀盐酸的烧杯中,恰好完全反应后,烧杯中物质的总质量比反应前减少了4.4g。 求大理石中碳酸钙的质量分数是多少?
某实验小组为测定氯酸钾样品中氯酸钾质量分数,取一定质量的该样品与7g二氧化锰混合,其总质量为32g.加热完全分解后剩余的固体质量为22.4g。(样品中的杂质不参与化学反应)
(1)完全反应后剩余固体的成分是______________________________
(2)样品中氯酸钾的质量分数是多少?
为测定某石灰石矿中碳酸钙的含量,现称取12.5g石灰石矿样品与足量的稀盐酸反应(杂质不溶于水,也不参与反应),得到二氧化碳气体4.4g(假设生成的气体全部逸出)。请计算:该石灰石样品含CaCO3的质量分数?
取氯酸钾和二氧化锰的混合物26g,加热至混合物固体质量不再减少为止,冷却后称得剩余固体质量为16 .4g。计算:
(1)生成氧气的质量
(2)原混合物中氯酸钾的质量
取氯酸钾和二氧化锰的混合物26g,加热至混合物固体质量不再减少为止,冷却后称得剩余固体质量为16.4g。计算:
(1)生成氧气的质量
(2)原混合物中氯酸钾的质量
称取5.8g某生铁样品放入94.6g稀盐酸中,恰好完全反应(生铁样品中的杂质不溶于水也不与盐酸发生反应),产生0.2g氢气.试计算反应后所得溶液中溶质的质量分数.
某工厂化验室用20%的氢氧化钠溶液洗涤一定量石油产品中的残余硫酸,共消耗氢氧化钠溶液20g,洗涤后的溶液呈中性。这一定量石油产品中含H2SO4的质量是多少?(写出计算过程)
在氯化钙和氯化钠的混合物中加入一定量的水,全部溶解得到50克混合溶液,向该溶液中逐滴加入一定溶质质量分数的碳酸钠溶液,生成沉淀与加入碳酸钠溶液的质量关系如图所示、计算:
(1)所加碳酸钠溶液的溶质质量分数
(2)若恰好完全反应时所得溶液的溶质质量分数为10%,则原固体混合物的质量是多少?
(1)用氯化钠固体配制100 g溶质质量分数为12%的NaCl溶液的操作步骤为 、 、 、 。如果将这100 g溶质质量分数为12%的NaCl溶液加水稀释为4%的NaCl溶液需加水 g。
(2)某课外兴趣小组对实验室中的一瓶稀硫酸样品进行分析。他们分别用100g稀硫酸与不同质量的锌粒(含杂质,杂质不与稀硫酸反应)反应,三次实验的数据如下表。
| 实验次数 |
1 |
2 |
3 |
| 加入锌粒的质量(g) |
4 |
8 |
12 |
| 充分反应后剩余物质的总质量(g) |
103.9 |
107.8 |
111.8 |
请回答下列问题:
①第 次实验,锌粒与稀硫酸恰好完全反应。
②计算稀硫酸的质量分数(写出计算过程)。
向182.5g一定浓度的盐酸中加入一定量的锌粉(杂质不溶于水也不与盐酸反应)
| 加入锌粉的质量/g |
7.0 |
14.0 |
21.0 |
28.0 |
35.0 |
42.0 |
| 溶液的质量/g |
188.8 |
195.1 |
a |
207.7 |
214.0 |
214.0 |
分析数据,试计算[第(2)问需写出计算过程]
(1)a= 。
(2)盐酸中溶质的质量分数?
试题篮
()