为测定某工厂排放的废水中氢氧化钠的含量,化学兴趣小组将100g该废水与50g硫酸铜溶液混合恰好完全反应,得到4.9g沉淀。请计算这一废水中氢氧化钠的质量分数。
根据化学方程式进行计算。二氧化碳通入足量的石灰水生成沉淀10g,与石灰水中的氢氧化钙反应的二氧化碳是多少g?
金属材料在生产、生活中有广泛的应用,认识金属的性质有利于更好地利用金属。
(1)铁在初中化学实验中多次亮相,如图展示了铁钉的一系列变化。

I.变化①是铁钉与空气中的 发生了反应。
II.变化②中常见除去铁锈的化学方程式为 。
III.如表是小明同学记录的锌粉与稀硫酸反应过程中反应时间与产生气体体积的变化数据:
时间(min) |
1 |
2 |
3 |
4 |
5 |
氢气体积(mL) |
50 |
120 |
230 |
290 |
310 |
实验数据反映,该反应速率的特点是 ,引起该速率变化的原因是 。
(2)将m克锌和铁的混合物放入硝酸铜溶液中,充分反应,经过滤、洗涤、干燥后,固体仍为m克,则反应后滤液中一定含有的溶质是 (填化学式)。
实验室用100g 溶质质量分数为 6.8%的过氧化氢溶液与少量二氧化锰混合制取氧气,计算完全反应后生成氧气的质量是多少?(写出计算步骤,计算结果保留一位小数)
氯化钠是重要的化工原料,氯碱工业生产的一种流程如图:
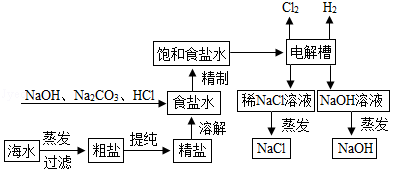
(1)从“海水→粗盐→精盐”的过程包括溶解、过滤、蒸发等实验操作,实验室中上述3种操作都需要使用的仪器是 (填名称)
(2)“食盐水”中常含有NaCl、MgCl2、CaCl2等物质,“精制”过程中加入NaOH的目的是 。
(3)写出“电解槽“中发生反应的化学方程式 ,流程中可以循环使用的物质有 (填化学式)
(4)氯碱工业生产的碱样品中常含有Na2CO3和NaCl等杂质,用“离子交换膜法”生产的碱样品质量主要标准如下表所示
等级 |
氢氧化钠含量 |
碳酸钠含量 |
优等品 |
≥99.0% |
≤0.5% |
一等品 |
≥98.5% |
≤0.8% |
合格品 |
≥98.0% |
≤1.0% |
①你认为碱样品中含有Na2CO3的原因是 ,检验碱样品中是否含有Na2CO3,下列试剂中可选择使用的是
a.酚酞 b.稀盐酸c。澄清石灰水
②李老师设计和完成了如下实验来判断碱样品的等级。
称取20.3g碱样品,加足量水溶解,再加入足量的氯化钡溶液,充分反应后,过滤得到滤渣和滤液;将滤渣洗涤,干燥得到碳酸钡(BaCO3)固体0.197g;向滤液中加入几滴酚酞,再逐滴加入稀盐酸至恰好完全反应,共消耗溶质质量分数为5%的稀盐酸365g。该碱样品的等级是 (不考虑其他杂质参加反应)
铁的冶炼与利用是学习和研究化学的重要课题。
Ⅰ.铁的冶炼。竖炉炼铁的工艺流程如图1所示。
(1)“燃烧室”中CH4燃烧的作用是
(2)写出“还原反应室”中炼铁的一个反应的化学方程式 。
(3)CH4与高温尾气中的CO2或H2O都能反应生成CO和H2,则16g CH4在催化反应室中完全反应后,理论上得到H2的质量(m)范围是 。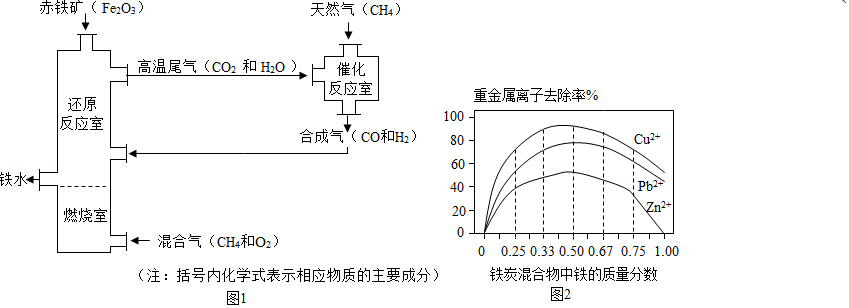
Ⅱ.铁的利用,利用铁炭混合物(铁屑和活性炭的混合物)处理含有Cu(NO3)2,Pb(NO3)2和Zn(NO3)2的铜冶炼废水。在相同条件下,测量总质量相同、铁的质量分数不同的铁炭混合物对水中重金属离子的去除率,实验结果如图2所示。
(1)铁炭混合物中铁的质量分数为100%时,水中的Cu2+、Pb2+能被除去、而Zn2+不能被除去,其原因是 。
(2)铁炭混合物中铁的质量分数为0时,也能除去水中少量的重金属离子,其原因是 。
(3)处理效果最好时,铁炭混合物中的铁的质量分数为 。
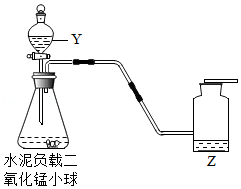
如图装置可用于多次连续进行氧气的制取和性质的实验。
(1)仪器Y的名称是 。
(2)水泥负载二氧化锰小球用于实验时的主要优点是 。该实验中收集氧气的方法是 。
(3)做氧气的性质实验时,实验不同,Z的作用不同。
①铁丝燃烧。Z为水,其作用是 。
②硫粉燃烧。Z为NaOH溶液,其作用是 。
③蜡烛燃烧。Z为 ,其作用是验证蜡烛中含有碳元素。
(4)实验时需要1.6g氧气,至少需要加入多少克5%的过氧化氢溶液。(写出计算过程)
金属具有广泛的应用。
(1)铁锅用来炒菜,主要是利用铁的 性(填“导热”或“导电”)。
(2)图为洁净铁钉的有关实验。

①中铁与硫酸铜反应的化学方程式为 。
②中铁钉锈蚀主要是铁与空气中的氧气和 发生化学反应。
③中铁锈与稀硫酸反应的化学方程式为 。
(3)某炼铁厂要冶炼1000t含杂质3%的生铁,需要含Fe2O380%的赤铁矿石的质量是 t(计算结果精确至0.1t)。
(4)某金属粉末可能由镁、锌、铁、铝、银中的一种或几种组成。取该样品2.4g,向其中加入100g一定溶质量分数的稀硫酸,恰好完全反应,生成0.2g氢气,得到无色溶液,固体无剩余。下列说法正确的是 (填序号)。
A.样品中一定含有镁
B.样品中一定不含有银,可能含有铁
C.所得溶液中溶质总质量为12g
D.加入的稀硫酸的溶质质量分数为19.6%
酸、碱、盐在生产生活中具有广泛的用途。
(1)化学实验室有失去标签的稀硫酸、氢氧化钠、氢氧化钙、碳酸钠、氯化钡五瓶无色溶液,现将其任意编号:A、B、C、D、E,然后两两组合进行实验,其部分现象如表(微溶物视为可溶物):
实验 |
A+B |
A+C |
A+D |
B+C |
现象 |
产生气体 |
产生沉淀 |
产生沉淀 |
产生沉淀 |
①写出溶液B、C中溶质的化学式:B ,C 。
②写出溶液A与D反应的化学方程式 。
(2)我国制碱工业先驱侯德榜发明了“侯氏制碱法”,其主要化学原理:
NaCl+H2O+NH3+CO2=NaHCO3↓+X;
2NaHCO3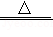 Na2CO3+H2O+CO2↑等。
Na2CO3+H2O+CO2↑等。
回答下列问题:
①X的化学式为 。
②将碳酸钠和碳酸氢钠的混合物l0g充分加热至质量不再改变,冷却,称量剩余固体质量为6.9g,则原混合物中碳酸钠和碳酸氢钠的质量比为 (写最简比)。
金属材料广泛应用于生产生活中。
(1)常温下大多数金属都是固体,但体温计中的金属却是液体,该金属是 。
(2)铝在空气中与氧气反应,其表面生成一层致密的氧化物薄膜,从而阻止铝进一步氧化。这种氧化物的化学式为 。
(3)向含有氯化铜、氯化锌、稀盐酸的混合溶液中加入过量铁粉,充分反应后过滤,滤液中含有的溶质是 (写化学式)。
(4)铁矿石有多种,如赤铁矿(主要成分Fe2O3)和磁铁矿(主要成分Fe3O4)等。
①写出赤铁矿石中的主要成分与一氧化碳反应的化学方程式 。
② 冶炼2900t含四氧化三铁80%的磁铁矿石, 理论上能得到含杂质2%的生铁的质量是 t(结果精确到0.1)。
(5)含有锌粉6.5g、铁粉5.6g、铜粉3.2g、铝粉1.8g的混合物与一定质量的稀硫酸充分反应,反应停止后,有6g固体剩余。则生成氢气的质量为 g。
化学不仅支持高新技术的快速发展,还为解决能源、资源等问题提供有效途径。
(1)2019年1月,嫦娥四号登月探测器成功登陆月球表面。构成月球探测器的部件有碳化硅(SiC)光学仪器、有机高分子反光板、钛合金筛网车轮等,其中碳化硅(SiC)属于 材料。
(2)港珠澳大桥在建造过程中使用了大量的不锈钢钢筋,主要利用了其强度高和 的性质。
(3)将生活垃圾中的可燃物分离出来对其进行处理可以得到汽油、煤油等燃料,从而实现资源的循环再利用。下列生活垃圾中能实现上述转化的有 (填序号)。
a.废铁 b.玻璃 c.易拉罐 d.废塑料
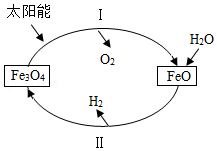
(4)太阳能的利用为人类提供充足的氢能源。工业上以太阳能为能源,利用铁的氧化物循环分解水制氢气的流程如图所示:
①过程Ⅰ、Ⅱ中能量转化的形式依次是太阳能→ →热能。
②写出过程Ⅱ反应的化学方程式 。
③当过程Ⅱ中得到ag H2时,过程I中得到的O2质量为 g。
碳及其氧化物性质的应用。
(1)如图所示,向盛有红棕色二氧化氮气体的集气瓶里投入几小块烘烤过的木炭,红棕色消失,说明木炭具有 能力,其原因是木炭具有 的结构。
(2)在书写具有保存价值的档案时,规定应使用碳素墨水,原因是 。
(3)将一定质量的金刚石在足量的氧气中充分燃烧,固体全部消失,写出反应的化学方程式 ;将生成的产物用足量的氢氧化钠溶液来充分吸收并测定其质量,当金刚石的质量恰好等于 时,则可证明金刚石是由碳元素组成的单质。
(4)在实验室里,检验二氧化碳一般用澄清石灰水,而吸收二氧化碳常用氢氧化钠溶液,理由是 。
(5)写出碳在高温时还原氧化铜的化学方程式,并计算要使80g氧化铜完全还原,需要碳的质量至少是多少?(在答题卡上写出计算过程)
氯化钠是重要的化工原料,氯碱工业生产的一种流程如图:
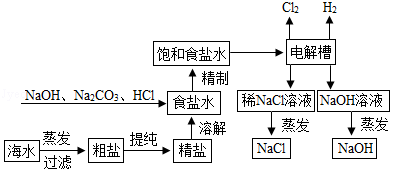
(1)从“海水→粗盐→精盐”的过程包括溶解、过滤、蒸发等实验操作,实验室中上述3种操作都需要使用的仪器是 (填名称)
22等物质,“精制”过程中加入NaOH的目的是 。
(3)写出“电解槽“中发生反应的化学方程式 ,流程中可以循环使用的物质有 (填化学式)
23和NaCl等杂质,用“离子交换膜法”生产的碱样品质量主要标准如下表所示
等级 |
氢氧化钠含量 |
碳酸钠含量 |
优等品 |
≥99.0% |
≤0.5% |
一等品 |
≥98.5% |
≤0.8% |
合格品 |
≥98.0% |
≤1.0% |
23的原因是 23,下列试剂中可选择使用的是
a.酚酞 b.稀盐酸c。澄清石灰水
②李老师设计和完成了如下实验来判断碱样品的等级。
3)固体0.197g;向滤液中加入几滴酚酞,再逐滴加入稀盐酸至恰好完全反应,共消耗溶质质量分数为5%的稀盐酸365g。该碱样品的等级是 (不考虑其他杂质参加反应)
铁的冶炼与利用是学习和研究化学的重要课题。
Ⅰ.铁的冶炼。竖炉炼铁的工艺流程如图1所示。
4燃烧的作用是
(2)写出“还原反应室”中炼铁的一个反应的化学方程式 。
422242的质量(m)范围是 。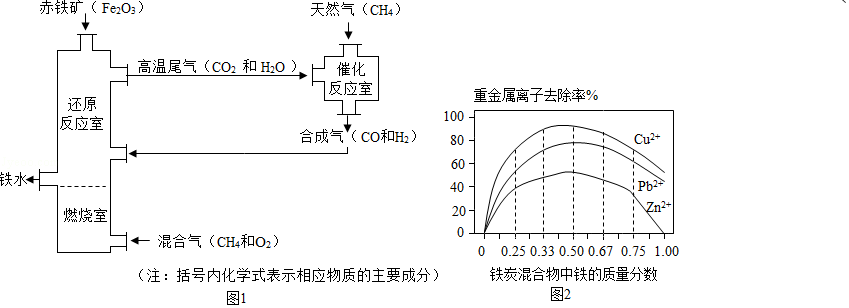
323232的铜冶炼废水。在相同条件下,测量总质量相同、铁的质量分数不同的铁炭混合物对水中重金属离子的去除率,实验结果如图2所示。
2+2+2+不能被除去,其原因是 。
(2)铁炭混合物中铁的质量分数为0时,也能除去水中少量的重金属离子,其原因是 。
(3)处理效果最好时,铁炭混合物中的铁的质量分数为 。
试题篮
()