早在西汉时期的《淮南万毕术》中就记载“曾青得铁则化为铜”,成为现代湿法冶金的先驱,现将2.8g铁粉投入40g硫酸铜溶液中,充分搅拌后,两者恰好完全反应.请计算:
(1)反应后生成铜的质量是多少?
(2)反应前硫酸铜溶液中溶质的质量分数是多少?
(3)反应后溶液中溶质的质量分数是多少?(结果精确至0.1%)
某锥形瓶盛有盐酸和氯化铜的混合溶液100g,向其中逐滴加入溶质质量分数为10%的氢氧化钠溶液,锥形瓶内溶液质量与滴入的氢氧化钠溶液的质量的变化关系如图所示。请计算:
(1)反应至A点时加入氢氧化钠溶液的质量为 ;
(2)计算反应至B点时锥形瓶内所得溶液的溶质质量分数为多少?(计算结果保留至0.1%)

小苏打常用作焙制糕点的发酵剂,为测定某小苏打样品的纯度,现取样品10g加热到质量不在减少(杂质不参加反应),共收集到二氧化碳2.2g,求样品中小苏打的纯度。提示:碳酸氢钠受热分解的化学方程式:2NaHCO3 Na2CO3+H2O+CO2↑
Na2CO3+H2O+CO2↑
实验室用200g质量分数为3.4%的过氧化氢溶液与少量二氧化锰混合制氧气,完全反应,生成氧气的质量是多少?
用煤直接做燃料如果不进行处理,会因煤中的硫生成SO2气体造成大气污染。
(1)现有南方产的一种煤含硫8%.某火力发电厂燃烧100t这种煤,假设燃烧时煤中的硫全部转化为SO2,则产生SO2的质量是多少?
(2)如在煤中混入粉末状的石灰石,则燃烧产生的SO2会与CaCO3反应生成CaSO3进入炉渣而减少大气污染。取50g此炉渣(含24%CaSO3)逐滴加入20%的盐酸,请在如图坐标中画出相应的曲线图(纵坐标为盐的质量,请设定具体物质;并标出曲线中必要的数据)。
[已知]①设炉渣已不含石灰石,炉渣其它成分不与盐酸反应;
②CaSO3和盐酸反应类似于CaCO3。
(3)向燃烧后的烟气喷洒石灰浆也可吸收SO2生成CaSO3.现用一万元分别购买两种原料来除去SO2,相关数据如表:
方法 |
物质 |
相对分子质量 |
纯度 |
价格(元/t) |
除SO2的量(t) |
A |
石灰石 |
100 |
90% |
200 |
14.4 |
B |
熟石灰 |
74 |
94% |
500 |
14.6 |
方法B比方法A除SO2的量略大,而且工业上多数采用方法B.其原因分别是: 。
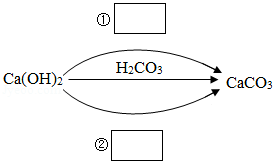
(1)化合物可以分为酸、碱、盐及氧化物。在下图中填写不同类别的物质(填化学式)实现Ca(OH) 2一步转化为CaCO 3。
(2)某Ca(OH) 2样品部分变质为CaCO 3(假设其成分均匀)。化学兴趣小组按以下步骤测定该样品中Ca(OH) 2的质量分数。
①配制盐酸:配制500g质量分数为6%的盐酸,需要质量分数为30%的盐酸 g。
②实验测定:
称取10.0g样品置于烧杯中,加入足量稀盐酸充分反应,烧杯总质量与反应时间的关系如下表所示:
| 反应时间/min |
0 |
t 1 |
t 2 |
t 3 |
| 烧杯总质量/g |
280.0 |
278.9 |
277.8 |
277.8 |
完全反应后,生成的CO 2气体的质量为 g。
③数据处理:计算该样品中Ca(OH) 2的质量分数(根据化学方程式的计算写出完整的计算步骤)。
某化学兴趣小组取部分变质的Ca(OH)2(含杂质CaCO3)样品4.0g投入200.0g水中,充分搅拌,通入足量CO2,溶液质量与反应的CO2质量的关系如图所示.则:
(l)Ca(OH)2全部转化为CaCO3时消耗的CO2质量为 g;
(2)4.0g样品中杂质CaCO3的质量为多少?(写出计算过程)
(3)通入m3gCO2时,溶液中生成物的溶质的质量分数为 (精确到0.1%).若所取样品中的Ca(OH)2没有完全溶于水,对最后的计算结果 (填“有”、“没有”)影响.原因是 .

我国矿物种类齐全,储量丰富。工业上从从含有金属元素的矿石中提炼金属。其中赤铁矿是炼铁的主要原料。请回答下列问题:
I.铁制品广泛应用于生产、生活中。
(1)下列不属于铁合金的是 (选填字母)。
A.Fe(OH)3 B.生铁 C.不锈钢
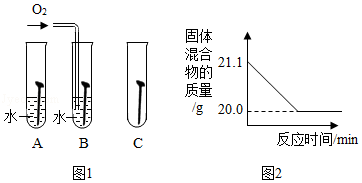
(2)铁钉生锈,属于 变化(选填“物理”“化学”):如图1是探究铁钉在不同条件下发生生锈的实验,其中铁锈蚀最快的是 (选填字母)。
II.赤铁矿(主要成分为Fe2O3)可用于生产催化剂。
(3)在Fe2O3中,氧元素的质量分数为 。
(4)赤铁矿经提纯后得到的纯净Fe2O3可用于生产某种工业催化剂(主要成分为FeO和Fe2O3),其反应原理为:2 Fe2O3+C 4FeO+CO2↑.现将焦炭和过量的Fe2O3混合均匀,按上述原理充分反应,如图2为固体混合物的质量随反应时间的变化曲线。
①由图可知:生成CO2气体的质量为 g。
②计算反应后固体混合物中FeO的质量分数(请根据化学方程式写出完整的计算步骤)。
过氧化钙(CaO2)是一种环境友好的化工原料,工农业生产中用作漂白剂、种子消毒剂以及鱼类运输时的制氧剂等。过氧化钙与水反应方程式为:2CaO2+2H2O═2Ca(OH)2+O2↑。
(1)若用150g某过氧化钙工业样品可制得氧气32g,请计算该过氧化钙样品的纯度(样品中CaO2的质量分数)是多少?
(2)往150g上述过氧化钙工业样品中逐渐加入水至过量,在如图中画出产生氧气的曲线图。
(3)下表为市面上某种过氧化钙和过氧化钠(化学式为Na2O2,化学性质与CaO2类似)样品的一些数据:
物质 |
相对分子质量 |
纯度 |
价格(元/kg) |
Na2O2 |
78 |
98% |
25 |
CaO2 |
72 |
94% |
24 |
用3000元购买样品制氧气,请通过计算说明购买哪种产品可制得更多的O2(已知用3000元购买过氧化钙样品可制得26.1kg O2)?

(1)化学兴趣小组的同学欲除去某FeCl2溶液中混有的CuCl2杂质,实验操作步骤如下:
①在混合溶液中加入过量的 粉(只有一个正确选项,选填字母),搅拌,使其充分反应:
A.铁 B.铜 C.银
②过滤,得到FeCl2溶液和金属混合物.
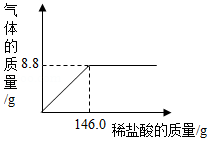
(2)该小组同学欲继续探究上述②得到的金属混合物中Cu的质量分数,将该金属混合物洗涤、干燥,称得其质量为28.0g.向此金属混合物中逐滴滴加稀盐酸,产生氢气的质量与加入稀盐酸溶液的质量关系如图所示,完成下列问题:
①计算该金属混合物中Cu的质量分数.(请根据化学方程式写出完整的计算步骤)
②该实验中,有同学认为还可以通过测定其他数据来计算Cu的质量分数,实验时他需要测定的实验数据应是 .

某化学兴趣小组同学为回收一块质量为40g的铜锌合金中的铜,将该合金放入烧杯中,逐渐加入稀硫酸至不再产生气泡时,恰好用去稀硫酸100g,烧杯内剩余固体27g。
请完成下列分析及计算。
(1)40g铜锌合金中锌的质量是 g。
(2)计算所用稀硫酸中溶质的质量分数。
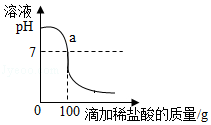
将含有NaCl杂质的某烧碱样品10g完全溶于90g水中,再向所得溶液中慢慢滴入溶质质量分数为7.3%的稀盐酸.在实验过程中,溶液的pH与滴入稀盐酸的质量关系如图所示.
(1)求l0g该样品中氢氧化钠的质量.
(2)求a点时,溶液中溶质的质量分数(计箅结果精确到0.1%)
为了节约林木资源,近几年兴起了一种含碳酸钙的“石头纸”,这种“石头纸”是用沿海水产养殖中大量废弃贝壳制得的,为测定其中碳酸钙(杂质不溶于水也不与水反应)的含量。某校化学兴趣小组的同学进行了如下实验(水和氯化氢的挥发忽略不计);取25.0g样品粉碎放入烧杯中,加入一定质量分数的稀盐酸,所加稀盐酸的质量与生成气体的所量关系如图所示:
(1)计算“石头纸”中碳酸钙的质量分数。
(2)完全反应后烧杯内溶液的溶质的质量分数是多少?(结果精确到0.1%)
试题篮
()