随着人们对酒驾危害认识的加深,司法机关对于酒驾、醉驾的处罚将日趋加重。醉酒的原因是酒中含有的乙醇对人的神经系统有刺激作用。交警对呼气酒精检验的原理是:橙色的K2Cr2O7酸性溶液遇乙醇会迅速变成蓝绿色。
白酒是乙醇的水溶液,酒中的乙醇在微生物作用下能被氧化成乙酸。小刚家有一瓶密封存放的白酒,他想知道该白酒的组成情况,于是进行如下实验探究:
【提出问题】该白酒中的溶质主要有哪些?
【查阅资料】材料一:乙醇(C2H5OH),俗称酒精,易溶于水,水溶液呈中性。在加热条件下,可以把氧化铜还原为单质铜。
材料二:乙酸(CH3COOH),又名醋酸,易溶于水,具有酸的通性。
【提出猜想】猜想1:只有乙醇
猜想2:只有乙酸
猜想3:
【实验探究】
| 实验操作 |
实验现象 |
实验结论 |
| ①取少量白酒于试管中,滴入几滴橙色的K2Cr2O7酸性溶液 |
|
猜想3成立 |
| ② |
|
【实验反思】操作①能否改为“将加热后的表面有黑色氧化铜的铜丝插入盛有白酒的试管中”? ,理由是 。
实验室可以用草酸(H2C2O4)在浓硫酸的作用下来制取一氧化碳,反应原理为:
H2C2O4 CO↑+ CO2↑+ H2O
CO↑+ CO2↑+ H2O
小明同学设计下图所示装置来制取一氧化碳,并验证一氧化碳的性质。 
请回答下列问题:
(1)长颈漏斗a的漏斗颈没入液面下的目
的是 。
(2)B中氢氧化钠溶液的作用是 。
(3)C中澄清石灰水的作用是 。
(4)通过什么现象可以判断CO能与CuO反应? 。
(5)D中反应的化学方程式是 。
同学们在学习碱的化学性质时,进行了如下图所示的实验。
(1)写出甲实验中盐酸和氢氧化钠反应的化学方程式 。
(2)乙实验中滴加氢氧化钠溶液后,可观察到的现象是 。
(3)丙实验中观察到试管内有白色沉淀产生。
(4)实验结束后,同学们将甲、乙、丙三个实验的废液倒入同一个干净的废液缸中,最终看到废液浑浊并呈红色,产生疑问。
【提出问题】废液中含有哪些物质?
【交流讨论】①一定含有的物质:碳酸钙、指示剂、水和 (写物质名称)。
②还含有能使废液呈碱性的物质.能使废液呈碱性的物质是什么?同学们有如下猜想。
小云认为:只有碳酸钠;小红认为:只有氢氧化钙;小林认为:是氢氧化钠和碳酸钠
【实验设计】小方想用氯化钙溶液来验证小云、小红、小林的猜想。查阅资料获悉氯化钙溶液呈中性,并设计如下实验。请你将小方的实验设计补充完整。
| 实验内容 |
预计现象 |
预计结论 |
| 取少量废液缸中上层清液于试管中,加入过量氯化钙溶液,静置。 |
①有白色沉淀,溶液呈红色。 |
小林的猜想正确。 |
| ② 。 |
小云的猜想正确。 |
|
| ③没有白色沉淀,溶液呈红色。 |
小红的猜想正确。 |
【反思拓展】在分析化学反应后所得物质的成分时,除了考虑生成物外还需考虑 。
下列4个图象分别代表对应的4种过程,其中正确的是 ( )
| A.分别加热等质量的氯酸钾与高锰酸钾,反应过程中生成氧气的质量变化 |
| B.向含有盐酸的氯化铜溶液中滴加烧碱溶液,产生沉淀的质量变化 |
| C.向盛有10g氧化钠固体的烧杯中加水配成100g溶液,溶液中溶质的质量分数变化 |
| D.将质量分数为20%的食盐水稀释至10%,稀释过程中溶质的质量变化 |
氧化铜矿石含有CuO、Cu2(OH)2CO3和Fe2O3,还含有一些不溶于水、不溶于酸的其他杂质。铜、铁是畜禽所必需的微量元素。某饲料厂联合生产硫酸铜和硫酸铁工艺流程如下:(提示:溶液中当pH=3.8时硫酸铁全部转化为Fe(OH)3沉淀,pH=6.4时硫酸铜全部转化为Cu(OH)2沉淀)
(1)氧化铜矿石粉碎的目的是____ 。
(2)写出“酸浸”中Cu2(OH) 2CO3发生反应的化学方程式 。
(3)“中和/过滤”中加入CaCO3的目的是 。
(4)上述工艺流程中多处涉及“过滤”,实验室中过滤操作需要使用的玻璃仪器有 。
(5)Fe(OH)3与硫酸反应的化学方程式 。
(6)“烘干粉碎”的实验结果如表所示。 
表中,m为CuSO4·5H2O晶体的质量,x为干燥后所得晶体中结晶水的个数。据此可确定由CuSO4·5H2O脱水得流程中所示产品的适宜工艺条件分别为 、 (分别指出温度和时间)。
以下是一些常见物质间互相转化的关系图(有些反应条件已省略):
已知高温下CO能与多种金属氧化物反应生成相应的金属和CO2。下列关系图中,A、B、X、Y均为无色气体,E、F为常见金属。
(1)根据上图判断B的化学式为 ;黑色固体甲的化学式为 ;Y的化学式为 。
(2)写出黑色固体乙和稀硫酸反应的化学方程式 。
(3)X除了与黑色固体甲、乙反应外,请再举一例说明X还能发生化合反应,写出反应的化学方程式 。F物质的一种用途是 。
(4分) 现有一包粉末,已知它们可能由Na2SO4、FeCl3、BaCl2、Na2CO3、KNO3中的一种或几种组成,某学生的实验过程如下:
①取少量粉末于试管中,加足量水溶解,过滤得白色固体和无色溶液;
向所得白色固体中加足量的稀盐酸,固体没有溶解。试回答:
(1)由上述实验记录推断:原粉末中一定不含 ,一定含有 ,可能含有 。
(2)生成白色固体的化学方程式 。
根据下列实验得出的结论,正确的是
| A.某固体加入稀盐酸,产生了无色气体,证明该固体一定含有CO32- |
| B.某溶液中滴加BaCl2溶液,生成不溶于稀硝酸的白色沉淀,该溶液中一定有SO42- |
| C.验证某烧碱样品中是否含有Cl-,先加入稀盐酸除去OH-,再加入AgNO3溶液,有不溶于稀硝酸的白色沉淀出现,证明含有Cl- |
| D.某无色溶液滴入酚酞溶液后显红色,该溶液不一定是碱溶液 |
在学习盐的性质时,某组同学将碳酸钠溶液和一瓶标签破损的溶液M(如图)
进行反应,有白色沉淀产生,过滤后得到澄清滤液。同学们对该实验进行了一系列的探究。
Ⅰ.定性探究:
探究一:M溶液中的溶质是什么?
(1)【提出猜想】该组同学认为M溶液的溶质有两种可能:
①是 ,
②是CaCl2.
【收集资料】CaCl2水溶液呈中性。
(2)【设计实验】同学们设计了如下方案并进行实验:
| 实验操作 |
实验现象 |
实验结论 |
| 取少量M溶液于试管中,向其中滴加 |
|
猜想①正确。碳酸钠与其反应的化学方程式为 |
探究二过滤后澄清滤液中会有哪些溶质?
【提出猜想】猜想一:NaOH 和Na2CO3 ;
猜想二: ;
猜想三:NaOH 。
(3)【实验验证】同学们经过交流讨论,设计以下实验方案确定滤液中溶质的组成:
| 实验操作 |
实验现象 |
实验结论 |
| 分别取少量滤液于A、B两支试管中,A中加入CaCl2溶液, B中加入 溶液 |
若A中产生白色沉淀,B中没有沉淀 |
“猜想一”成立 |
| |
“猜想二”成立 |
|
| |
“猜想三”成立 |
Ⅱ.定量探究:
【提出问题】过滤后澄清滤液中NaOH的质量分数是多少?
【设计实验】
小明同学取100g过滤后澄清滤液于烧杯中,向烧杯中逐滴加入过量的稀盐酸,产生的气体与所加入稀盐酸质量关系如下图所示:计算过滤后澄清滤液中NaOH的质量分数是多少?(请列出计算过程)
下列图象能正确反映实验过程中相应量变化的是
① ② ③ ④
| A.图①:将接近饱和的硝酸钾溶液缓慢降温 |
| B.图②:向一定量的氢氧化钡溶液中加过量稀硫酸 |
| C.图③:向氢氧化钠溶液中加水 |
| D.图④:向一定量的稀硫酸中加入过量的锌 |
下列四个图像中,能正确表示对应变化关系的是 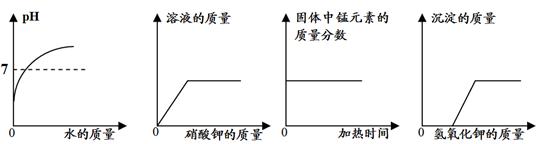

| A.向一定量稀盐酸中加水稀释 |
| B.一定温度下,向不饱和硝酸钾溶液中加入硝酸钾 |
| C.加热一定量的高锰酸钾固体 |
| D.向盐酸和氯化镁的混合溶液中滴加氢氧化钾溶液 |
过氧化钠(Na2O2)是一种淡黄色固体。在一次科技活动中,某化学兴趣小组的同学将包有Na2O2固体的棉花放入了如图1的实验中,发现了高低不同的两根蜡烛,下面的蜡烛先熄灭,上面的蜡烛后熄灭;同时也惊奇地发现棉花燃烧了起来。
(1)实验过程中“下面的蜡烛先熄灭,上面的蜡烛后熄灭”的现象说明二氧化碳具有
、 的性质。
(2)棉花为什么会燃烧呢?小组同学认为棉花要燃烧,除了满足“棉花是可燃物”这一条件,还另需满足a: 、 b: 两个条件。
[提出问题]:在上述实验中是如何给棉花提供a和b这两个燃烧条件的呢?
[查阅资料]:1、在常温下Na2O2和CO2能发生化学反应。
2、无水硫酸铜为白色固体,吸水后变为蓝色。
[设计实验]:经过讨论后,小组同学设计了如下图2的实验进行探究。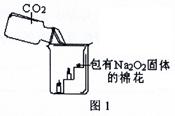
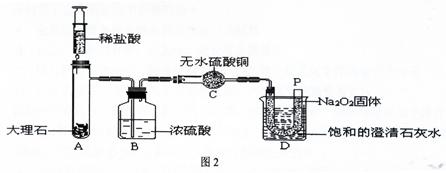
[实验步骤]:①检查整套装置的气密性;②把相关的试剂放入对应的仪器内(D装置的U型管内放有足量的Na2O2固体,烧杯内盛有饱和的澄清石灰水),并按图2组装整套实验仪器;③用力推动针筒的活塞,把稀盐酸注入试管内;④一段时间后,在P处放置一根带火星的小木条,观察现象。
注:整个实验中不考虑稀盐酸的挥发和空气对实验的影响。
[实验现象]:①无水硫酸铜没有变蓝色;②带火星的小木条复燃;③饱和的澄清石灰水变浑浊。
[实验分析]:①浓硫酸的作用是: 。
②D装置的烧杯内澄清石灰水变浑浊的原因是 。
[得出结论]:①“小木条复燃”说明Na2O2和CO2反应产生的一种气体,使图1中的棉花满足了燃烧的一个条件;②“饱和的澄清石灰水变浑浊”说明Na2O2和CO2反应将 能转化为热能,使图1中的棉花满足了燃烧的另一个条件。
[拓展提高]:①Na2O2和CO2反应除生成一种气体外,还生成了一种固体,小明认为生成的固体是NaOH,小红认为是Na2CO3,同学们经过思考后认为 同学的猜想是错误的,理由是: 。
②Na2O2和CO2反应的化学方程式是 。
下列所示的图象能反映相对应实验的是( )
| A.向pH=13的NaOH溶液中不断加水稀释 |
| B.向碳酸氢钠溶液中逐滴加入稀盐酸至过量 |
| C.将60℃接近饱和的硝酸钾溶液恒温蒸发水分至有白色晶体析出 |
| D.将足量的相同质量分数的稀硫酸和等质量金属镁片和锌片混合 |
下列有关化学实验的“目的→操作→现象→结论”的描述都正确的是
| 选项 |
目的 |
操作 |
现象 |
结论 |
| A |
比较铝和铜的金属活动性 |
将砂纸打磨过的铝丝 浸入到硫酸铜溶液中 |
铝丝表面有红色固体析出 |
铝比铜活泼 |
| B |
检验露置在空气中的氢氧化钠溶液是否变质 |
取氢氧化钠溶液,滴入稀盐酸 |
开始时没有观察到气泡产生 |
氢氧化钠溶液没有变质 |
| C |
探究物质溶解于 水时的热量变化 |
向一定量水中加入硝酸铵晶体,充分搅拌 |
溶液温度下降 |
盐类物质溶解于水时,都会吸热 |
| D |
检验集气瓶中是否集满二氧化碳 |
将燃着的木条伸入集 气瓶中 |
木条火焰熄灭 |
集气瓶中已集满 二氧化碳 |
试题篮
()