科学兴趣小组在调查一化工厂时,发现有个车间排出的废水澄清透明,呈黄色.为测定该废水中所含的物质,他们进行如下实验(假设能发生的反应均恰好完全反应):
(1)用pH试纸测试,测得pH为2.
(2)取一定量废水溶液,加入Ba(NO3)2溶液,无现象.
(3)另取一定量废水溶液,加入AgNO3溶液后,过滤,得到白色沉淀A和滤液.
(4)向滤液中加入NaOH溶液,得到红褐色沉淀B.
由此可知:该废水溶液呈 性;所得的红褐色沉淀B为 ;废水溶液中肯定含有的盐是 .
鸡蛋腐败会发出一种无色、有臭鸡蛋气味的气体(H2S).硫化氢气体是一种大气污染物,它在空气中点燃能完全燃烧生成二氧化硫和水,把硫化氢气体通入浓硫酸中,发生的反应为:H2S+H2SO4(浓)=SO2+S↓+2H2O
(1)从上述叙述中,归纳出硫化氢的物理性质:① 、② ;硫化氢的化学性质是:① 、② .
(2)若工厂排放的尾气中含有硫化氢,用浓硫酸来吸收是否可以? ,原因是 .
对于氢氧化钠溶液而言,溶质的质量分数越大,溶液的碱性越强。
(1)若要测定该溶液的酸碱度,可选用下列选项中的 。
① 无色酚酞试液 ②紫色石蕊试液 ③pH试纸
(2)常温下,5%的氢氧化钠溶液的pH 2%的氢氧化钠溶液的pH(填“小于”、“大于”或“等于”)。
(3)如果要减小氢氧化钠溶液的pH,你采取的方法有:
①不发生化学反应的方法是 ;
②发生化学反应的方法有 、 (答出两种,所选用物质的类别不同)。
如图所示,在粗玻璃管内壁上粘附湿润的石蕊试纸,向细玻璃管里滴入数滴浓醋酸后,立即封闭管口.10s后即观察到:仅有中下部的石蕊试纸从上往下逐渐变色.
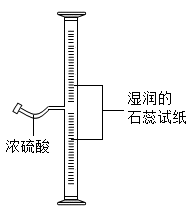
(1)本实验应选用 (填“红”或“蓝”)色石蕊试纸;
(2)本实验利用的醋酸性质包括:①酸性、② 性、③醋酸蒸气密度 (填“<”或“>”)空气密度;
(3)由实验现象可推知微粒具有的特征是 ;
(4)本实验用试剂Y代替浓醋酸也出现相似的现象,Y为 (填序号).
A.浓氨水 B.浓硫酸 C.浓盐酸.
某校举行了一次化学实验技能比赛,某参赛同学抽到的题目是:现有
、
、
、
四瓶无色溶液,它们分别是盐酸、氯化钙溶液、氢氧化钾溶液、碳酸钠溶液中的一种,要求不使用任何试剂将它们鉴别出来.该同学采用两两相互反应方法进行实验,其相互反应实验现象如下表:("↑"表示气体,"↓"表示沉淀,"﹣"表示无明显现象).
| \ |
A |
B |
C |
D |
| A |
\ |
↑ |
↓ |
﹣ |
| B |
↑ |
\ |
﹣ |
﹣ |
| C |
↓ |
﹣ |
\ |
﹣ |
| D |
﹣ |
﹣ |
﹣ |
\ |
请完成下列问题:
(1)
是,
是(填化学式)。
(2)写出
与
发生反应的化学方程式。
固体混合物A是由
、
、
、
、
、
中的几种混合而成为,为确定其成分,进行如图实验.(假设每步反应均恰好完全反应)

试推断:
(1)气体B是。
(2)固体A中一定没有的物质是。
(3)滤液D中一定有含有的溶质是。
(4)固体A的组成可能有种。
某化学小组向一定量
和
混合溶液中加入一定量的
粉,充分反应后过滤得溶液
和固体
.
对滤液
所含的溶质有以下几种猜想:
①
、
、
② 、
③ 、
④只有
经过讨论大家一致认为不合理的猜想是(填标号),其理由是.
【实验探究】若猜想④成立,通过以下实验可确定固体
的成分,请将下表填写完整.
| 实验步骤 |
现 象 |
固体
的成分 |
| 有气泡产生 |
结合
、
的相关知识,回答下列问题
(1)可用来改变酸性土壤的固体是;
(2)从微观角度看,它们的溶液具有相似化学性质的原因是;
(3)除去
溶液中混有的少量
,可选用的试剂是。
请分析、比较以下几组化学反应,得出结论。
| 组别 |
化学方程式 |
结论 |
| I |
|
反应物相同,生成物不同, 原因。 |
| II |
|
反应物相同,生成物不同, 原因。 |
| III |
|
反应物相同,生成物不同, 原因。 |
| IV |
(反应缓慢) (反应迅速) |
反应物相同,反应速率不同, 原因。 |
| 实践与应用 |
科学探究正努力实现对化学反应的控制,很多化学家致力于研究二氧化碳的"组合转化"技术,把过多二氧化碳转化为有益于人类的物质。若让二氧化碳和氢气在一定条件下反应,可生成一种重要的化工原料,反应的化学方程式如下: ,推断X的化学式是。 |
酸、碱、盐在生活、生产中应用广泛,使用时必须十分小心,氢氧化钠具有强烈的,实验时最好戴防护眼镜,为了便于理解和记忆,小丽同学总结了碱的化学性质如图,请你根据要求完成下列问题:

(1)小丽同学发现,以前取用氢氧化钠溶液时试剂瓶忘记盖瓶塞,依据反应③说明
必须密封保存,否则在空气中要变质,如果该溶液变质,则发生反应的化学方程式为;
(2)要检验该氢氧化钠溶液已变质,选择下列试剂不能达到目的是
| A. |
稀 |
B. |
酚酞试液 |
C. |
|
D. |
|
(3)为了验证反应④,小丽将无色酚酞试液分别滴入
溶液和澄清石灰水中,溶液由无色变成红色,原因是它们在水溶液中能电离出。
(4)依据反应②,
能与下列物质反应的是.
| A. |
|
B. |
|
C. |
|
D. |
|
发生反应的化学方程式为:.
(5)硫酸铵[ ]、磷酸二氢钙[ ]、亚硝酸钠( )、硝酸钾( )等属于盐,其中又属于复合肥的。
小明同学利用已使用过的生石灰干燥剂和敞口放置在空气中的烧碱固体进行了一系列实验,如下是他的实验记录:
①取干燥剂和烧碱固体同时放入水中,搅拌后过滤,得到白色固体甲和滤液乙。
②把白色固体甲分成两份,一份放入水中,搅拌后过滤,向滤液中滴加无色酚酞,滤液为无色;另一份加入溶液丙,产生气泡。
③向滤液乙中加入过量溶液丁,充分反应后过滤,得到白色固体甲和滤液,向滤液中滴加无色酚酞,滤液为无色。
④试根据以上的实验记录,回答下列问题:
(1)①步骤中的白色固体甲来源于
(2)滤液乙、溶液丙、溶液丁三种溶液的溶质所属的物质种类有 (填序号)
A.酸 B.碱 C.盐
(3)写出步骤③中发生的化学反应方程式:
(4)下列说法正确的是( )
A.生石灰干燥剂仍有干燥作用
B.生石灰干燥剂已完全失效
C.烧碱固体部分变质
D.烧碱固体完全变质
请你和同学们一起完成下列实验。
(1)用浓盐酸(溶质质量分数为37%,密度为1.18
)配制200
10%稀盐酸。
①配制的主要步骤为:计算、、溶解。
②设需浓盐酸的体积为
,请列出
的计算式(不必算出结果)。
③现提供下图仪器,仪器
的名称为;配制过程中还需要的仪器有。

(2)现提供下列装置:

①实验室制取二氧化碳,发生和收集装置应选用(填序号),发生反应的化学方程式为。实验结束,从反应残留物中提取固体溶质时,按如下流程操作:

②如选用另一发生装置制取某种气体,发生反应的化学方程式为。
硫酸亚铁铵晶体俗称摩尔盐,化学式为FeSO4·(NH4)2SO4·6H2O,在制药、电镀方面有广泛的应用。某化学兴趣小组的学生用含有少量铜的废铁屑制备硫酸亚铁铵晶体,流程如下:
资料:①硫酸亚铁铵晶体易溶于水,不溶于酒精;硫酸亚铁铵晶体在100℃~110℃时分解。
②相关物质的溶解度(单位:g)如下表:
| 温度/℃ |
FeSO4 |
(NH4) 2SO4 |
FeSO4·(NH4)2SO4·6H2O |
| 10 |
20.0 |
73 |
17.2 |
| 20 |
26.5 |
75.4 |
21. 6 |
| 30 |
32.9 |
78 |
28.1 |
请回答下列问题:
(1)实验前,先用碳酸钠溶液浸泡废铁屑表面油渍。碳酸钠溶液可除去油渍是因为碳酸钠溶液的pH 7(选填“>”、“<”或“=”)。
(2)①中发生反应的化学方程式为 。
(3)操作①中过滤时,要趁热进行的原因是 ,过滤后得到的固体中一定含有的物质是 。
(4)操作③中使用无水酒精洗涤,可快速晾干。这样做的优点是 (填字母)。
A.避免用水洗涤所造成的晶体损耗
B.酒精易挥发,可低温晾干晶体
已知某固体混合物A中可能含有
、
、
、
、
五种物质中的两种或多种。按下述步骤进行实验探究,观察实验现象,并加以分析推理(设过程中所有发生的反应都恰好完全反应)。
I.取一定质量的该固体混合物A放入一洁净烧杯中,向其中加入适量
溶液,搅拌,待烧杯中物质充分反应后,过滤,得红褐色沉淀
和滤液
。
Ⅱ.另取一定质量的该固体混合物A放入另一洁净烧杯中,向其中加入适量
溶液,搅拌,待烧杯中物质充分反应后,过滤,得白色沉淀
和滤液
。
III.将所得滤液C和滤液E充分混合,再向混合后的溶液中加入适量
溶液,待充分反应后,过滤,得白色沉淀
和滤液
。
Ⅳ.根据上述实验过程和发生的现象做出相应推理,填写以下空白:
(1)在固体混合物A里,上述五种物质巾肯定存在的物质是(写化学式)
(2)写出步骤III中生成白色沉淀F的1个化学方程式
(3)在滤液
中,含有的金属阳离子共有种,该滤液中肯定存在的酸根离子。
(4)在混合物
里,上述五种物质中肯定不存在的物质是(写化学式)。得出此结论的理由是。
(10分)在20mL溶质质量分数为1.60%的某硫酸铜溶液中,逐滴加入某浓度的氢氧化钡溶液(发生的反应类似于硫酸铜和氢氧化钠的反应),用电导仪测得溶液的电导率(电导率越高表示溶液的导电性越好)、溶液的pH值随滴入Ba(OH)2溶液体积的变化曲线如下图所示(假设所有稀溶液的密度均为l g/cm3)
(1)硫酸铜和氢氧化钡溶液发生反应的化学方程式为: :
(2)图I中C点所示溶液中,含量较多的微粒有: ,D点所示溶液能导电是因为溶液中含有 ;
(3)从图II中可知:将打磨过的铝片放入上述该硫酸铜溶液中,可以观察到的现象是: ;如有固体析出,请写出反应的化学方程式 。
试题篮
()