(5分)化学小组的同学探究二氧化碳与氢氧化钠的反应,实验方案如下:
| 实验装置 |
实验步骤及操作 |
实验现象 |
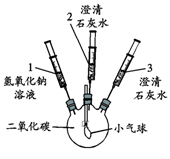 |
① 将注射器1中的溶液推入充有CO2的瓶中 |
气球鼓起 |
| ② 向外拉注射器2的活塞 |
无明显现象 |
|
| ③ 将注射器3中的溶液推入瓶中 |
瓶中液体变浑浊,气球无明显变化 |
|
| ④ 向外拉注射器2的活塞 |
无明显现象 |
(1)此实验不能证明CO2能和NaOH反应的原因是 。
(2)若仍要用此装置完成实验证明CO2能和NaOH反应,则步骤③注射器3中的溶液应更换为 ,对应的实验现象是 。
(3)步骤③注射器3中的溶液更换后,步骤④中对应的实验现象应为 ,发生反应的化学方程式为 。
红枣包装中常使用一种袋装防腐剂,品名为“504双吸剂”,其标签如图所示。同学们对一包久置的“504双吸剂”固体样品很好奇,设计实验进行探究。
提出问题:久置固体的成分是什么?
查阅资料:铁与氯化铁溶液在常温下发生反应生成氯化亚铁。
作出猜想:久置固体中可能含有Fe、Fe2O3、CaO、Ca(OH)2、CaCO3。
久置固体中可能含有Ca(OH)2的原因是:
用化学方程式表示 。
实验探究1:甲同学的方案(见下表)。
| 实验操作 |
实验现象 |
实验结论 |
| (1)取少量固体放于试管中,加足量蒸馏水溶解,静置后取上层清液滴加无色酚酞溶液 |
固体溶解时试管外壁发烫,试管底部有不溶物,溶液变红 |
固体中一定含有 和氢氧化钙 |
| (2)另取少量固体放于试管中,滴加足量 的 |
固体逐渐消失,有大量无色气体产生,得到浅绿色溶液 |
固体中一定含有 , 一定不含有Fe2O3 |
| (3)将步骤(2)中产生的气体通入到澄清石灰水中 |
|
固体中一定含有CaCO3 |
实验质疑:(1)乙同学认为甲同学的实验中的实验中不能得出一定含有Ca(OH)2的结论,理由是 。
(2)丙同学认为甲同学的实验并不能得出一定不含Fe2O3的结论,理由是 。
实验探究2:乙、丙同学设计如下图所示实验方案继续验证。
(1)③中反应的化学方程式是 。
(2)乙、丙同学实验中又能得出固体样品中一定还含有 ,
仍有一种物质不能确定,该物质是 。
纳米碳酸钙是一种重要的无机化工产品,下图是某厂生产纳米碳酸钙的工艺流程。
请回答下列问题:
(1)请完成并配平该工艺中生成CaCO3固体的反应方程式:
CaCl2+_________+CO2 CaCO3↓+__________+H2O
CaCO3↓+__________+H2O
(2)若在实验室中进行该实验,操作l的名称是 ,使用到的玻璃仪器有玻璃棒、________、_________,其中玻璃棒的作用是 。
(3)操作2为洗涤、干燥,其中洗涤的目的是除去碳酸钙粗品表面含有的可溶性杂质,其中一定含有的可溶性杂质是 ,检验是否洗涤干净的方法是向最后一次洗涤液中加入 溶液(①Ca(OH)2 、② AgNO3、③ CaCl2,填写序号),如果没有出现沉淀,说明已经洗涤干净。
(4)上述流程中的副产品(NH4Cl)可用作_____________________。(写一种用途)
取实验室中部分变质的NaOH样品配成溶液,向其中滴加稀盐酸,绘制出生成的CO2的质量与加入的盐酸的质量关系如右图所示,下列有关说法正确的是
| A.OA段没有发生任何化学反应 |
| B.A点溶液中的溶质只有NaCl |
| C.B点表示加入的盐酸与原溶液中的溶质恰好完全反应 |
| D.C点的溶液的pH=7 |
某化学兴趣小组对某品牌牙膏中摩擦剂成分及其含量进行探究,查阅资料如下:
1、该牙膏摩擦剂由碳酸钙、氢氧化铝组成;
2、牙膏中其它成分遇到盐酸无气体生成;
3、碱石灰的主要成分为生石灰和氢氧化钠固体。
利用下图所示装置(图中夹持仪器略去)进行实验,充分反应后,测定B中生成的BaCO3沉淀的质量,以确定碳酸钙的质量分数。请回答下列问题: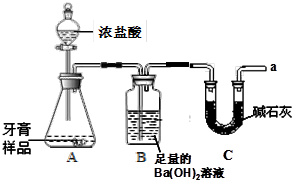
(1)B中反应生成BaCO3的化学方程式是 。
(2)C装置的作用是 。
(3)下列各项措施中,不能提高测定准确度的是 (填序号)。
| A.在加入盐酸之前,应排净装置内的CO2气体 |
| B.滴加盐酸不宜过快 |
| C.在A~B之间增添盛有浓硫酸的洗气装置 |
| D.在A~B之间增添盛有饱和碳酸氢钠溶液的洗气装置 |
(4)有同学认为该装置测定出来的碳酸钙质量分数会偏低,他的理由是
,解决方法是 。
(5)某同学认为不必测定B中生成的BaCO3质量,将B中的Ba(OH)2溶液换成浓H2SO4 ,通过测定C装置反应前后的质量差也可以测定CaCO3的质量分数。实验证明按此方法测定的结果明显偏高,原因是 。
(6)实验中准确称取8.00g样品三份,进行三次测定,测得BaCO3平均质量为3.94g 。请计算样品中碳酸钙的质量分数。(写出计算过程)
下列反应制取气体,可用如图装置制取、干燥和收集的是
A Zn+H2SO4=ZnSO4+H2↑
B 2H2O2 2H2O+O2↑
2H2O+O2↑
C CaCO3+2HCl=CaCl2+H2O+CO2↑
D 2NH4Cl+Ca(OH)2 CaCl2+2NH3↑+2H2O
CaCl2+2NH3↑+2H2O
(7分)为了确定某不纯的硝酸钠溶液中所含杂质的成分.一同学设计了如下实验:
请回答下列问题:
(1)白色沉淀A的化学式为______________,I、Ⅱ为 ___________操作。
(2)无色溶液B中加Na2CO3溶液,反应的化学方程式为________________。
(3)经分析,原溶液中的杂质由一种或几种物质组成。杂质的成分可能是(填写三种即可)①________________②_______________ ③ _
金属在生产和生活中具有广泛的应用。
(1)下列金属制品的用途中,利用金属导热性的是 (填字母序号)。
(2)人类每年从自然界提取大量的金属,其中提取量最大的是铁。赤铁矿(主要成分为Fe2O3)和一氧化碳炼铁的化学方程式为 。
(3)铁制品容易锈蚀,铁生锈的条件是 。
(4)某工厂废液中含有氯化钠、氯化铜和氯化亚铁。某课外小组利用废液制取海绵铜(Cu)和氧化铁两种产品,过程如下图所示(过程中不引入其他元素)。
请回答下列问题:
①溶液D中的溶质为 ;
②检验C过量的方法是 ;
③A~G七种物质中含铁元素的物质有 (填字母序号)。
(7分) 据报道,一辆载满20t电石的货车,在高速路上发生意外,燃起大火并伴有大量黑烟,这辆货车在雨中燃烧了很长时间。某化学小组对电石中碳化钙(CaC2)的性质产生了兴趣,进行了下列探究活动。
【查阅资料】①碳化钙与水反应生成一种可燃性气体和一种白色固体。
②乙炔(C2H2)气体燃烧时伴有大量黑烟。
【猜想假设】甲同学对碳化钙与水反应的生成物作出如下猜想:
可燃性气体可能是:①氢气 ②氧气 ③乙炔
白色固体可能是: ①氧化钙 ②氢氧化钙 ③碳酸钙
(1)你认为甲同学猜想的理由是 。
(2)其他同学讨论后认为甲同学的猜想有不合理之处,请指出并说明理由
。
【实验探究】
步骤1:取适量碳化钙加水,收集生成的气体,验纯后点燃,气体燃烧,伴有大量黑烟,说明碳化钙与水反应产生的气体是 。
步骤2:取适量反应后生成的固体于试管中, ,说明碳化钙与水反应产生的固体是氢氧化钙。
【反思交流】
(1)碳化钙与水反应的化学方程式为 。
(2)下列说法正确的是 (填字母序号)。
| A.碳化钙与水反应放热 |
| B.碳化钙应贮存在阴凉干燥的库房 |
| C.碳化钙与水反应可用于测定电石中碳化钙的含量 |
| D.实验室用电石与水制乙炔的发生装置与制氧气完全相同 |
人们曾用贝壳(主要成分是碳酸钙,杂质不参加反应且不溶于水)和纯碱为原
料制取烧碱,某小组同学按图所示流程进行实验,请你参与讨论并回答相关问题。
(1)贝壳高温煅烧时,发生反应的化学方程式是________________________________。
(2)水加入到固体A中的反应是________(填“吸热”或“放热”),操作Ⅰ中用到的玻璃
仪器有烧杯、________、玻璃棒;将溶液蒸发结晶至________________时停止加热。
(3)将固体C配成溶液,其溶液中一定含有的溶质是________,写出该物质的其中的一种用途________________________________________________。
下列图像与对应选项关系合理的是
| A.在某温度下,向一定量接近饱和的硝酸钾溶液中,不断加入硝酸钾晶体 |
| B.向NaOH溶液中滴中稀盐酸至过量 |
| C.用相等质量的氯酸钾来制取氧气 |
| D.电解水生成氢气和氧气 |
归纳总结是化学学习的常用方法,下图是对生成物质A的反应关系的归纳与整理。
请回答下列问题:
(1)写出A的化学式: ,反应③
的基本厦应类型是 。
(2)写出反应⑤的化学方程式:
。
该反应在医疗上的用途是: 。
(3)反应⑥能够进行的原因是 。
(4)请根据上图的反应关系,总结出盐酸化学性质。(任写2点)
、 。
下列图像能正确反映所对应叙述关系的是
| A.向氢氧化钠溶液中不断加水 |
| B.向不饱和的硝酸钾溶液中加入硝酸钾固体 |
| C.向H2S04和CuS04混合液中滴加NaOH溶液 |
| D.煅烧一定质量的石灰石 |
类推是学习中常用的思维方法,现有以下类推结果,其中正确的是
| A.碱的水溶液通常呈碱性,所以碱性溶液一定是碱的溶液 |
| B.氧化物都含有氧元素,所以含氧元素的化合物一定是氧化物 |
| C.酸碱发生中和反应生成盐和水,所以生成盐和水的反应一定是中和反应 |
| D.化合物是由不同元素组成的纯净物,所以只含一种元素的物质不是化合物 |
试题篮
()