如图所示a~g是初中化学常见的物质。图中“→”表示转化关系,“—”表示相互能反应。已知a是人体胃液中含有的酸,g是最轻的气体,b、c、d、e、f都是氧化物。以下说法不正确的是
| A.g是理想的燃料 |
| B.e与f发生的化学反应类型是化合反应 |
| C.b和c物质中所含元素相同 |
D.c、d发生反应的化学方程式只能是3CO+Fe2O3 2Fe+3CO2 2Fe+3CO2 |
取露置于空气中部分变质的NaOH样品配成溶液,向其中逐滴滴加过量的稀盐酸。能正确反映其变化的图像是
阅读下面科普短文。
肼(N2H4)又称联氨,有类似于氨的刺鼻气味,贮存时用氮气保护并密封,用途广泛。肼燃烧放热量大且燃烧产物对环境无污染,常用作火箭燃料,点燃时与助燃物质液态N2O4发生反应,生成N2和H2O。高压锅炉水处理时用于脱除氧气以防止锅炉的腐蚀,也可以把锅炉内表面锈蚀后的氧化铁还原为结构紧密的四氧化三铁保护层,减缓锅炉锈蚀。用于烟草、土豆、玉米的贮藏,用于食用盐酸的制造等。熔点1.4℃,沸点113.5℃;有强烈的吸水性,形成水合肼(N2H4·H2O),可以用固体烧碱进行脱水;能吸收空气中的二氧化碳;易溶于水;与液氧接触能自燃;长期暴露在空气中或短时间受热时易发生分解。对眼睛有刺激作用,能引起延迟性发炎,对皮肤和粘膜也有强烈的腐蚀作用。
依据短文内容,回答下列问题:
(1)肼的下列性质中,属于化学性质的是 (填字母序号,下同)。
A.与氧化铁作用 B.易溶于水
C.易分解 D.有刺鼻的气味
(2)肼在常温下为______(填“固态”“液态”或“气态”)。
(3)肼作为火箭燃料燃烧时反应的化学方程式为 。
(4)肼有强烈的吸水性,能吸收空气中的CO2,下列物质中的 也具有这些性质。
A.NaCl B.Ca(OH)2 C.NaOH D.NaHCO3
(5)肼需要密封保存的原因是______。
小张同学得知我国早在西汉时期,就能利用铁单质与硫酸铜溶液反应制取铜,其反应的化学方程式为.他利用硫酸铜进行趣味实验,将浸泡了色硫酸铜溶液的滤纸在酒精灯火焰上点燃,观察到滤纸颜色变白,由湿变干后燃烧.在燃烧后的灰烬中出现红色固体.他很好奇,进行了相关探究,请你参与并填写有关空白.
【提出问题】
红色固体是什么物质?它是如何产生的?
【查阅资料】
(1)温度达200℃时,
开始分解生成
和另一种氧化物;此反应前后各元素的化合价保持不变.
(2)温度超过1000℃,
才分解生成氧化亚铜(
);
呈红色.
【作出猜想】红色固体①可能是
;②也可能是
;③还可能是的混合物.
【实验探究】
(1)取红色固体观赏,呈亮红色;
(2)取少量红色固体于试管中,加入稀硫酸,固体不溶解,溶液仍为无色.
【分析推理】
(1)请教老师后得知,如有
存在,加入稀硫酸会发生如下反应:
结合实验探究的现象,确定亮红色固体为,同时也说明滤纸燃烧时的温度低于(填序号)
A.200℃ B.1000℃
(2)滤纸主要是由碳、氢、氧三种元素组成的,经分析,产生红色固体的原因可能是滤纸在燃烧过程中产生的碳与分解产生的
发生反应,生成亮红色固体和二氧化碳,请写出该反应的化学方程式.
【交流讨论】
(1)将浸有硫酸铜溶液的滤纸点燃,刚开始不能燃烧,是因为.
(2)此实验中,
受热分解生成
和(填化学式).
某班化学兴趣小组设计了如下图所示的实验装置,用来研究物质溶于水后温度的变化。
试猜想:
(1)装置A产生的现象是___________________,原因是________________。
(2)装置B产生的现象是___________________,原因是________________。
A、B、C、D、E、F是初中化学常见的六种物质,按要求回答下列问题:
(1)A、B为两种气体,所含元素种类相同,A有可燃性.物质间满足如下转化关系:(部分反应物和生成物已省略,“→”表示转化关系,下同) A⇌B⇌C
①写出B转化为A的化学方程式 ;
②物质C可以是 (写一种即可);
(2)D为一种气体单质,E为氧化物,E能与一种金属氧化物反应生成F并放出大量的热.物质间满足如下转化关系: D⇌E⇌F
①写出F的俗称 ;
②写出E转化为D的化学方程式 .
老师在装有酸的储物柜中发现一瓶没有标签的溶液,让同学们鉴定该溶液是否为盐酸溶液。
| 实验步骤 |
实验现象 |
实验结论 |
| 1.取少量待测液体与试管中,滴加几滴石蕊溶液 |
|
溶液呈酸性 |
| 2.取少量待测液与试管中,滴加 溶液 |
产生了白色沉淀 |
该待测溶液为盐酸 |
| 3.往上述2中的沉淀滴加 溶液 |
|
写出上述操作2中所发生的化学方程式: 。
固体混合物A是由
、
、
、
、
、
中的几种混合而成为,为确定其成分,进行如图实验.(假设每步反应均恰好完全反应)

试推断:
(1)气体B是。
(2)固体A中一定没有的物质是。
(3)滤液D中一定有含有的溶质是。
(4)固体A的组成可能有种。
重结晶后的食盐中往往还含有少量的硫酸钠、氯化镁、氯化钙等杂质,它们在溶液中主要以SO2﹣4、Ca2+、Mg2+的形式存在,为将这些杂质除净,可向食盐溶液中加入过量的氢氧化钠、碳酸钠、氯化钡溶液,然后加入盐酸调至溶液pH=7,最后经过过滤、蒸发得到精盐.下列操作及加入溶液顺序错误的是( )
| A.BaCl2、NaOH、Na2CO3、过滤、HCl |
| B.BaCl2、Na2CO3、NaOH、过滤、HCl |
| C.NaOH、BaCl2、Na2CO3、过滤、HCl |
| D.Na2CO3、BaCl2、NaOH、过滤、HCl |
用盐酸可以清除铁锈(主要成分为Fe203),盐酸中主要含有H20分子、H+、c1﹣.某探究小组为探究稀盐酸中的哪种微粒能使氧化铁溶解,设计了如下实验方案,得出了初步结论.
(1)请填写下表中的实验结论:
| 实验过程 |
实验现象 |
实验结论 |
| 向盛有少量Fe2O3的试管中加入NaCl溶液振荡 |
固体不溶解 |
|
(2)是否需要做“向Fe2O3,中加入水”的对比实验?为什么?
为提高实验探究能力,某化学兴趣小组的同学在老师的指导下,对一瓶久置出现变质硬化的氢氧化钙固体进行如下探究活动。
【探究活动一】检验硬化的氢氧化钙样品是否完全变质
(1)用化学方程式表示氢氧化钙变质的原因:__ _。
(2)检验氢氧化钙样品是否完全变质,进行如下实验:
| 实验步骤 |
实验现象 |
实验结论 |
| 取氢氧化钙样品少量,研细后加适量蒸馏水充分混合后静置, __ __ |
__ __ |
该样品还含有氢氧化钙 |
【探究活动二】测定样品中含有的变质固体(以下用R表示)的质量分数
取3克部分变质的氢氧化钙样品与足量的稀盐酸反应,测量生成气体的体积(气体不溶于植物油),从而计算出样品中R的质量,便可求出样品中R的质量分数。实验装置(气密性良好)如图1所示。
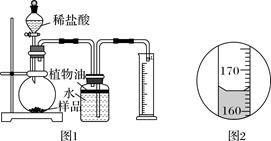
(3)将稀盐酸滴入样品中,产生气体的化学方程式为__ __,反应一段时间后,当观察到__ __(填实验现象),才停止滴加稀盐酸。
(4)实验中量筒的作用是_ _ _。
(5)实验结束后,量筒内进入水的体积如图2所示,其读数为__ __mL。已知在该实验条件下,生成气体的密度为2g·L-1,通过计算,样品中R的质量分数为__ _。
(6)上述图1所示实验装置和相关试剂,用来实验测定样品中R的质量分数是比较粗略的,请简要说明测定数据存在误差的原因:_ _(写一个)。
如图所示,在粗玻璃管内壁上粘附湿润的石蕊试纸,向细玻璃管里滴入数滴浓醋酸后,立即封闭管口.10s后即观察到:仅有中下部的石蕊试纸从上往下逐渐变色.
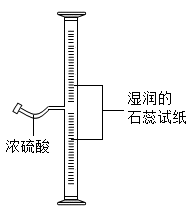
(1)本实验应选用 (填“红”或“蓝”)色石蕊试纸;
(2)本实验利用的醋酸性质包括:①酸性、② 性、③醋酸蒸气密度 (填“<”或“>”)空气密度;
(3)由实验现象可推知微粒具有的特征是 ;
(4)本实验用试剂Y代替浓醋酸也出现相似的现象,Y为 (填序号).
A.浓氨水 B.浓硫酸 C.浓盐酸.
由于二氧化碳与氢氧化钠反应无明显现象,对此同学们展开了探究,请你参与.
【提出问题】二氧化碳与氢氧化钠能否发生反应?
【查阅资料】常温下,氢氧化钠、碳酸钠在乙醇中的溶解性如下.
| 溶剂 |
乙醇 |
|
| 溶质 |
氢氧化钠 |
碳酸钠 |
| 溶解性 |
易溶 |
难溶 |
【方案设计】小明同学设计了如图所示装置进行探究。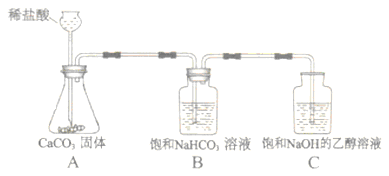
【实验探究】
(1)溶液配制.甲溶液:将一定质量的氢氧化钠固体加入到一定体积的乙醇中,用玻璃棒不断搅拌,使其成为饱和氢氧化钠的乙醇溶液.量取一定体积的乙醇要用到的仪器是,用玻璃棒搅拌的目的是。
乙溶液:将一定质量的氢氧化钠固体加入到一定体积的75%的乙醇溶液中,用玻璃棒不断搅拌,使其成为不饱和氢氧化钠的乙醇溶液.判断甲、乙溶液形成的现象是。
(2)进行实验,按图所示装置加入药品后进行实验.
中发生反应的化学方程式为,
装置的作用是,
中观察到的现象是。
【实验结论】
(3)由此小明得出二氧化碳与氢氧化钠发生了化学反应,反应的化学方程式为。
【反思交流】
(4)小刚同学认为小明的实验还足以证明二氧化碳与氢氧化钠发生了化学反应,还应补充的实验是。
(5)若将图
中甲溶液换成乙溶液进行实验,
中可能无明显现象发生,原因可能是。
下列选项符合图示从属关系的是
| |
X |
Y |
Z |
| A |
碱 |
酸 |
化合物 |
| B |
非金属单质 |
金属元素 |
元素 |
| C |
化合反应 |
氧化反应 |
化学反应 |
| D |
饱和溶液 |
不饱和溶液 |
浓溶液 |
试题篮
()