物质X可发生下列所示的两个反应,则X可能是( )
① X+碱→盐+H2O ② X+金属氧化物→盐+H2O
| A.CaO | B.CO2 | C.NaOH | D.H2SO4 |
不同物质的溶液的酸碱性不同,根据下表中PH的情况判断,下列说法中正确的是( )
| |
盐酸 |
CuSO4溶液 |
NaCl溶液 |
水 |
Na2CO3溶液 |
NaOH溶液 |
||||
| PH |
<7 |
<7 |
=7 |
=7 |
>7 |
>7
|
有一食品包装说明书中注明防腐剂是苯甲酸(C6H5COOH),张华同学查资料得知苯甲酸的酸性比醋酸强,可用做食品防腐剂。下列对苯甲酸性质的推测中不合理的是( )
| A.苯甲酸溶液的pH小于7 |
| B.相同浓度的苯甲酸溶液的pH比醋酸的pH大 |
| C.苯甲酸溶液能使紫色石蕊试液变红 |
| D.苯甲酸溶液不能使无色酚酞试液变色 |
因“对核糖体结构和功能的研究” 而获得2009年诺贝尔化学奖。核糖体是进行蛋白质合成的重要细胞器,蛋白质在酸、碱或酶的作用下能发生水解反应生成氨基酸,氨基酸分子中含有氨基(一NH2,具有碱的性质)和羧基(一COOH,具有酸的性质)。氨基酸分子具有的性质是( )
| A.只能与硫酸反应,不能与氢氧化钠反应 |
| B.只能与氢氧化钠反应,不能与硫酸反应 |
| C.既能与硫酸反应,又能与氢氧化钠反应 |
| D.既不能与硫酸反应,又不能与氢氧化钠反应 |
酸与碱作用生成盐和水的反应,叫做中和反应。它在工农业生产和日常生活中有广泛的用途。下列应用一定与中和反应原理无关的是( )
| A.施用熟石灰改良酸性土壤 | B.服用含Al(OH)3的药物治疗胃酸过多 |
| C.用熟石灰和硫酸铜配制波尔多液 | D.用NaOH溶液洗涤石油产品中的残余硫酸 |
实验室有一瓶久置的氢氧化钠固体,某同学想了解其变质情况,设计了实验,实验过程如下:
实验一:取少量样品于试管中,滴加适量稀盐酸,观察到有气泡产生,说明氢氧化钠已变质,变质的原因是___________________________(用化学方程式表示)。
实验二:
通过实验二,能进一步推算出氢氧化钠变质的程度。请计算实验二中参加反应的碳酸钠质量。(化学方程式:Na2CO3+ CaC12=CaCO3↓+2NaCl)
结论:16.0 g干燥的样品中已变质的氢氧化钠的质量是 g。
小政同学在复习Ca(OH)2化学性质时,归纳出了Ca(OH)2与其它物质间相互反应的关系如图4(图中“——”表示相连的两种物质能发生反应)。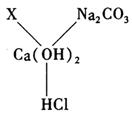
(1)若X是与其它三种不同类别的化合物,则X可以是_________。
(2)根据图4所示的物质间关系,写出其中两个化学方程式:
①________________________;②____________________________。
下列人体体液中,酸性最强的是( )
| |
A |
B |
C |
D |
| 体液 |
唾液 |
血液 |
胆汁 |
胃液 |
| pH范围 |
6.6 -7.1 |
7. 35 -7.45 |
6.8 -7.4 |
0.8 -1.5 |
化学小组同学用下图所示装置(夹持仪器已略去)做了2个兴趣实验。每次实验时,打开止水夹,均可见C瓶内的水流入D中,B中有气泡逸出。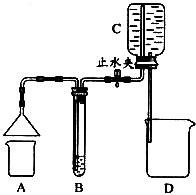
⑴在A处放置燃烧的蜡烛,B中无色溶液变浑浊,B中的试剂是__________。蜡烛燃烧生成的气体被吸入B中的原因是________________________。
⑵在A处放置某溶液,若B中盛有紫色溶液甲,则变红色;若B中盛有红色溶液乙,则变无色。乙可能是__________,结合A、B两处物质的性质解释乙变色的原因:______________________________。
氢氧化钴[Co(OH)2]受热易分解,能与酸性溶液反应,可作涂料和清漆的干燥剂,制备方法为:①Co+2HCl=CoCl2+H2↑②CoCl2+2NaOH=Co(OH)2↓+2NaCl下列判断正确的是( )
| A.钴的金属活动性比铜的弱 | B.①为置换反应②为复分解反应 |
| C.氢氧化钴的化学性质稳定 | D.氢氧化钴可以干燥氯化氢气体 |
(5分)甲、乙、丙三位同学对氯化镁样品(仅含氯化钠杂质)进行如下检测:各取5.0 g样品溶于一定量的水中得到25.0g溶液,再分别加入不同质量,溶质质量分数为10%的氢氧化钠溶液,反应得到沉淀的实验数据如下表:
| |
甲 |
乙 |
丙 |
| 加入氢氧化钠溶液质量 (g) |
35.0 |
40.0 |
45.0 |
| 反应得到沉淀的质量 (g) |
2.5 |
2.9 |
2.9 |
试回答下列问题:
(1)上述实验中,__ __同学所用的氢氧化钠溶液一定过量。
(2)求样品中氯化镁的含量(写出计算过程,结果精确到0.1%,下同)。
(3)计算乙同学实验后所得溶液中的氯化钠的质量分数。
小强为探究氢氧化钠溶液中到底是哪一种粒子(H2O、Na+、OH-)能使酚酞指示剂变色,设计了一组实验,实验步骤如下:
(1)在第一支试管中加入约2ml蒸馏水,滴入几滴无色酚酞试液,观察现象。
(2)在第二支试管中加入约2mlNaCl溶液(pH=7),滴入几滴无色酚酞试液,观察现象。
(3)在第三支试管中加入约2mlNaOH溶液,滴入几滴无色酚酞试液,观察现象。
通过上述试验探究,小强得到的结论应是:
实验(1)看到的现象是无色酚酞试液不变色,得出的结论是H2O 使酚酞变色,
实验(2)看到的现象是 ,得出的结论是Na+离子 。
实验(3)看到的现象是 ,得出的结论是 。
酸与碱作用生成盐和水的反应,叫中和反应。在用盐酸和氢氧化钠溶液进行中和反应的实验时,反应过程溶液的pH的变化曲线如图所示:
(1)要得到此变化曲线,所进行的操作是 (填序号)。
①将稀盐酸滴加到氢氧化钠溶液中 ②将氢氧化钠溶液滴加到稀盐酸中
(2)该反应的化学方程式
试题篮
()