硝铵是一种常见的化肥,化学式为 NH4NO3。试计算:
(1)求硝铵中各元素的质量比;
(2)求硝铵中氮元素的质量分数;
(3)硝铵的市场价格为810元/1000kg,某人用405元购买此化肥,问:相当于购买到了多少kg氮元素?
NH3常用来制取常见的氮肥。下图是两种化肥包装袋上的部分说明:

(1) NH4HCO3中N的质量分数是 。
(2) 碳酸氢铵化肥中NH4HCO3的质量分数是 。
(3) 两袋碳酸氢铵化肥与多少千克尿素化肥中的氮元素质量相等?(结果均保留一位小数)
某化学兴趣小组同学在进行实验室制取氧气时,取了34.0g 过氧化氢溶液,又称取了0.5g二氧化锰,放入烧杯中至不再产生气泡,称得烧杯内剩余物的质量为33.7g,
求:(1)生成氧气的质量是多少?
(2)参加反应的过氧化氢的质量是多少?
氯化钡溶液常用来检验硫酸,两者之间发生如下化学反应:BaCl2+H2SO4="BaSO4" ↓+2HCl。某同学将80g氯化钡溶液与20g稀硫酸混合,恰好完全反应,过滤后称得稀盐酸的质量为76.7g,求氯化钡溶液的溶质质量分数。
某补钙剂说明书的部分信息如右下图所示。现将有20片该药剂制成的粉末与50g盐酸混合(其他成分不与盐酸反应),恰好完全反应后称得剩余物的质量为65.6g。

(1)青少年缺钙出现的疾病是 。
(2)生成二氧化碳的质量是 g。
(3)参加反应的CaCO3质量为多少?
(4)该盐酸中溶质的质量分数是多少?(精确到0.1%)。
工业铁红的主要成分是Fe2O3,还含有少量的FeO、Fe3O4。为了测定铁红中铁元素的质量分数,兴趣小组的同学进行了如下实验,请你参与过程分析。
[资料1]碱石灰既能吸收水又能吸收二氧化碳;浓硫酸可以吸收水蒸气;
[资料2]实验室常用氢氧化钠溶液来除去CO2反应生成碳酸钠和水;用澄清的石灰水
来检验CO2气体;
[资料3]草酸晶体(H2C2O4·3H2O)在浓H2SO4作用下受热分解,化学方程式为:
H2C2O4·3H2O CO2↑+ CO↑+ 4H2O
CO2↑+ CO↑+ 4H2O
(1)下列可用作草酸分解制取气体的装置是 (填字母编号)。

【问题讨论】用下图所示装置进行实验:

A B C D E F
(2)实验前应先 。
(3)进入D中的气体是纯净、干燥的CO,则A、C中的试剂依次是 、 (填字母编号)。
a.浓硫酸 b.澄清的石灰水 c.氢氧化钠溶液
(4)写出A装置中发生的化学反应方程式 。
(5)B装置的作用是 。
(6)对D装置加热前和停止加热后,都要通入过量的CO,其作用分别是:
①加热前 。 ②停止加热后 。
(7)写出D装置中所发生反应的一个化学方程式 。
【数据分析与计算】
[资料4]铁的常见氧化物中铁的质量分数:
| 铁的氧化物 |
FeO |
Fe2O3 |
Fe3O4 |
| 铁的质量分数 |
77.8% |
70.0% |
72.4% |
(8)称取铁红样品10.0 g,用上述装置进行实验,测定铁红中铁的质量分数。
①D中充分反应后得到Fe粉的质量为m g,则 < m < 。
② 实验前后称得E装置增重6.6g,则此铁红中铁的质量分数是 。
【实验评价】
反思1:本实验中如果缺少C装置(不考虑其它因素),则测得样品中铁的质量分数会 (填“偏小”、“不变”或“偏大”)。
反思2:请指出【问题讨论】中实验装置的一个明显缺陷 。
环保石头纸的主要成分为碳酸钙,加入适量聚乙烯和少量胶合剂。
【实验一】 探究影响石头纸与盐酸反应快慢的因素
(1)甲、乙两同学设计实验如下:
| |
甲 |
乙 |
| 实验过程 |
 |
 |
| 现象 |
试管①、②、③中产生气泡快慢的顺序为:①>②>③。 |
|
| 分析结论 |
Ⅰ 碳酸钙与稀盐酸反应的化学方程式为 ; Ⅱ 对比甲同学实验①②可知, ,化学反应的速度越快; Ⅲ 对比甲同学实验 (填实验序号)可知,反应物的接触面积越大,反应速率越 。 Ⅳ 乙同学的实验中,应该连续记录的实验数据是 和 。 |
【实验二】 测定石头纸中碳酸钙的质量分数 提示:石头纸中其他成分均不与盐酸反应,也不溶于水。
(2)甲组同学:图Ⅰ为石头纸与稀盐酸反应的装置,图Ⅱ用于测量通常状况下CO2的体积。

①实验前首先要 ;
② 图Ⅱ装置中油层的作用是 ;
③ 反应完成后,先 (填具体操作),然后才能准确读得量气管中的CO2的体积。
④根据V CO2和ρCO2计算出CO2的质量,计算碳酸钙质量。
(3)乙组同学:均匀称取四份样品分别和稀盐酸反应,用电子天平及有关装置,得出二氧化碳质量,实验数据记录如下表。
| |
第1份 |
第2份 |
第3份 |
第4份 |
| 取样品质量(g) |
6.25 |
6.25 |
6.25 |
6.25 |
| 取稀盐酸的体积(mL) |
10.0 |
20.0 |
30.0 |
40.0 |
| 产生气体的质量(g) |
0.88 |
1.76 |
2.20 |
m |
通过对数据的分析和比较,回答下列有关问题
①在第 份样品的实验中,样品中碳酸钙完全反应了; 。
② m的值为
③石头纸样品中碳酸钙的质量分数是多少?(请写出计算过程)
为了测定黄铜(铜、锌合金)的组成,某研究性学习小组称取该样品20 g,向其中逐滴加入9.8%的稀硫酸至刚好不再产生气体为止。反应过程中生成的气体与所用硫酸溶液的质量关系如图所示。试计算:
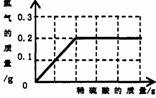
(1)样品中铜的质量分数;
(2)反应所消耗的硫酸溶液质量;
(3)反应后所得溶液中溶质的质量分数。
碘元素具有预防和治疗甲状腺肿的作用,人体缺碘时易患粗脖子病。为了消除碘缺乏病,我国政府规定居民的食用盐必须是加碘食盐,简称碘盐。所谓碘盐就是在食盐中加入一定量的碘酸钾。下表某精制碘盐包装袋上的部分文字说明:


(1)已知碘酸钾的化学式为KIO3,①碘酸钾中碘元素的化合价为 。 ②碘酸钾的相对分子质量为 。③一定量的碘酸钾中含有20g 碘,则碘酸钾的质量为 g。
(2)由食用方法和贮藏方法,可推测碘酸钾的化学性质之一是 。
(3)若1000g 碘盐中约含20 mg 碘,
①这里标明的碘的含量是指 ;
| A.碘单质 | B.碘元素 | C.碘原子 | D.碘分子 |
②已知成人每天约需 0.15mg 碘,假设这些碘主要是从碘盐中摄取的,则成人每天需要食用碘盐多少克(写出计算过程)?
市场上某钙制剂的说明书如下图所示,请仔细阅读,并进行计算。

(1)葡萄糖酸钙中的钙是指的 ;
A.钙这种物质 B.钙原子
C.钙元素 D.钙离子
(2)葡萄糖酸钙相对分子质量为 ;
(3)葡萄糖酸钙中C、H、O、Ca的原子个数比为 ;
(4)葡萄糖酸钙中氢、氧元素的质量比为 ;
(5)葡萄糖酸钙中钙元素的质量分数为 ;
(6)按说明书服用钙片时,每天能够补充的钙为 mg(精确到0.1)。
某化学兴趣小组为了测定一批石灰石样品中碳酸钙的质量分数,取用2g石灰石样品,把20g稀盐酸(氯化氢的水溶液)分四次加入样品中(样品中除碳酸钙外,其余的成分既不与盐酸反应,也不溶解于水)充分反应后经过过滤、干燥等操作,最后称量,得实验数据如下:
稀盐酸的用量 剩余固体的质量
第一次加入5g 1.5g
第二次加入5g 1.0g
第三次加入5g 0.5g
第四次加入5g 0.3g
(1)从以上数据可知,这四次实验中,第( )次石灰石样品中碳酸钙已完全反应。
(2)石灰石样品中碳酸钙的质量分数为 。
(3)求所用稀盐酸的溶质质量分数?(需要有解题步骤和过程)
试题篮
()