小黄同学为了测定某Cu﹣Ag合金中各金属的含量,取这种合金4.8 g与AgNO3溶液反应,加入AgNO3溶液的质量m与充分反应后所得固体的质量b的关系如图所示.请计算:
(1)AgNO3溶液中溶质的质量分数(结果精确 至0.1%);
(2)该合金中银和铜的质量比(结果精确至0.1).

某钢铁厂实验室为测定赤铁矿Fe 2O 3的含量,将矿石粉碎(其中杂质既不溶于水也不与酸反应),进行如下实验:

请回答下列问题:
(1)上述实验过程中发生反应的化学方程式为 ;
(2)样品中Fe 2O 3的质量分数是 ;
(3)根据已知条件列式求解200g稀硫酸中溶质质量(x)的比例式 ;
(4)若向最终滤液中加入16g水,所得不饱和溶液中溶质的质量分数为 ;
(5)该钢铁厂每天用上述赤铁矿石1900t来生产生铁,则理论上日产含杂质5%的生铁的质量为 .
某工厂从1000kg铝土矿(主要成分是Al 2O 3)冶炼得到270kg铝。反应的化学方程式是:2Al 2O 3(熔融)  4Al+3O 2↑。请计算。
4Al+3O 2↑。请计算。
(1)Al 2O 3中,Al、O原子个数比是 。
(2)列式计算该铝土矿中Al 2O 3的质量分数。
大理石是含杂质的碳酸钙,因具有美丽花纹而被广泛用于建筑物外墙、内壁的贴面和地面铺设。某同学想测出大理石样品中碳酸钙的含量,进行了如下实验和分析。

(1)取一定量的大理石样品置于图甲的发生装置中,用分液漏斗向下滴加盐酸(CaCO 3+2HCl=CaCl 2+H 2O+CO 2↑,杂质不参加反应),产生的气体用含有碱性物质的吸收装置充分吸收。分液漏斗中所加液体不选用硫酸,理由是 。
(2)反应前,测得图甲中锥形瓶内物质的总质量和吸收装置的总质量都为m克。实验后,根据实验数据绘制了图乙,曲线a、b分别表示锥形瓶内物质的总质量和吸收装置的总质量随反应时间变化的情况。请根据曲线b分析计算出大理石样品中碳酸钙的质量。
(3)请综合分析曲线a、b,计算出实验中所用盐酸的溶质质量分数。(结果精确到0.1%)
(4)计算后,该同学对上述实验进行了反思。他认为分液漏斗中选用的盐酸浓度偏大会对实验结果造成较大影响,其原因是 。
工业生产常用"苛化法"制取氢氧化钠。其原料为碳酸钠、石灰乳[由Ca(OH) 2和水组成的混合物],大致流程如图1。

科学兴趣小组模拟上述流程,在实验室中制备氢氧化钠。
(1)实验室进行"操作1"时,需要用到下列器材(图2)中的 (可多选)。
(2)制备氢氧化钠的化学方程式为,Na 2CO 3+Ca(OH) 2=2NaOH+CaCO 3↓.将53克溶质质量分数为20%的碳酸钠溶液与17克石灰乳混合,若二者恰好完全反应出计算所得氢氧化钠溶液的溶质质量分数。(写出计算过程,计算结果精确到0.1%)

洁厕灵是常用的陶瓷清洗液,小彭同学对某品牌洁厕灵的有效成分及其含量进行研究。
(1)查阅资料得知:洁厕灵有效成分是HCl.HCl的含量可通过已知溶质质量分数的NaHCO 3溶液来测定,其它成分均不参与反应。请完成HCl与NaHCO 3反应的化学方程式:HCl+NaHCO 3=NaCl+ +CO 2↑。
(2)配制一定溶质质量分数的NaHCO 3溶液,需要用到的玻璃仪器有烧杯、滴管和 。
(3)向一锥形瓶中加入100克该品牌的洁厕灵,再逐次加入相同质量分数的 NaHCO 3溶液,测出每次锥形瓶中反应后溶液的总质量,数据记录如下:
| |
第一次 |
第二次 |
第三次 |
第四次 |
第五次 |
| 加入NaHCO 3溶液的质量/g |
40 |
40 |
40 |
40 |
40 |
| 反应后溶液的总质量/g |
138.9 |
177.8 |
216.7 |
255.6 |
295.6 |
试分析计算下列问题:
①第一次实验时,所加 NaHCO 3溶液中溶质质量是多少克?
②该品牌洁厕灵中HCl的质量分数是多少?
海洋是一个巨大的宝库,从海水中得到的食盐不仅可作调料,还可作化工原料。氯碱工业就是以电解食盐水为基础的,化学方程式为:2NaCl+2H 2O  Cl 2↑+H 2↑+2NaOH.某科学兴趣小组模拟氯碱工业,将一定浓度的氯化钠溶液通电一段时间(只发生上述反应),收集到0.02克H 2.停止通电,向所得溶液中加入10克盐酸后,溶液恰好为中性。求:
Cl 2↑+H 2↑+2NaOH.某科学兴趣小组模拟氯碱工业,将一定浓度的氯化钠溶液通电一段时间(只发生上述反应),收集到0.02克H 2.停止通电,向所得溶液中加入10克盐酸后,溶液恰好为中性。求:
(1)电解过程中消耗氯化钠的质量。
(2)所加盐酸中溶质的质量分数(用化学方程式计算)。
用"盐酸﹣﹣硫化钡法"生产BaCl 2会放出有毒气体H 2S(其水溶液有酸性),可用NaOH吸收H 2S制取Na 2S进行处理。如表为H 2S回收工艺的各项生产成本:
表:H 2S回收工艺的各项生产成本
| 项目 |
单价(元/吨) |
| NaOH |
2500 |
| Na 2S |
5000 |
| 辅助费用(以处理1吨H 2S计) |
1114 |
(1)工业处理尾气需考虑经济效益和社会效益,根据上述资料分析,单从经济效益考虑这种处理H 2S的方法是 (选填"盈利"或"亏损")的。
(2)若某化工厂每天要处理10吨H 2S,需消耗NaOH多少吨?(写出计算过程,结果保留1位小数)
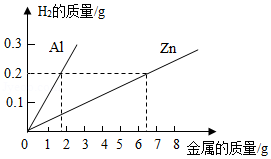
在学习了金属的化学性质后,科学老师布置了一项课外学习任务:调查化工颜料店出售的涂料添加剂"银粉"是什么金属?某学习小组通过调查,分别获得了"银粉"是银粉、铝粉、锌粉这三种不同结果。为了确定究竟是哪一种金属,学习小组同学将一小包"银粉"带回实验室,进行了如下实验和分析。(相关反应的化学方程式为:Zn+2HCl═ZnCl 2+H 2↑;2Al+6HCl═2AlCl 3+3H 2↑)
(1)取少量"银粉"于试管中,滴加适量盐酸,观察到有 产生,说明"银粉"一定不是银。
(2)为了进一步确定"银粉"是铝还是锌,学习小组通过理论计算,获得两种金属分别与足量盐酸反应产生氢气的质量关系,并绘制成如图所示图象。
(3)取1.8克"银粉"(杂质忽略不计)加入到50克稀盐酸中,恰好完全反应,生成氢气0.2克。根据如图可知,"银粉"是 。请计算:本实验所用稀盐酸的溶质质量分数为多少?
实验室有一变质的氢氧化钠样品(样品中只含碳酸钠杂质,且成分均匀),为测量样品中Na 2CO 3的质量分数,小明进行了如下实验。
①取质量、大小相同的3个烧杯,分别加入一定质量分数的稀盐酸100克;
②向上述3个烧杯中分别加入3份质量不同的样品;
③充分反应后,再用电子天平称量烧杯及烧杯内物质的总质量(假设产生的气体完全逸出)。实验数据如下:
| |
实验一 |
实验二 |
实验三 |
| 反应前稀盐酸+烧杯质量(克) |
150 |
150 |
150 |
| 反应前固体样品质量(克) |
4 |
8 |
12 |
| 反应后烧杯内物质+烧杯质量(克) |
m |
155.8 |
158.7 |
已知实验中发生的化学反应:NaOH+HCl═NaCl+H 2O
Na 2CO 3+2HCl═2NaCl+H 2O+CO 2↑
(1)分析表中数据,写出判断实验二中的样品已完全反应的理由: 。
(2)表中的m值为 。
(3)根据实验二中的数据计算样品中Na 2CO 3的质量分数。
某兴趣小组设计如下实验探究质量守恒定律。
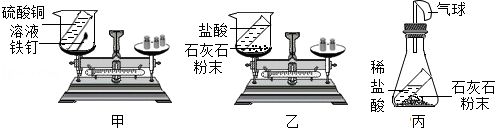
(1)如图甲,小柯将烧杯放在天平左盘,使天平重新平衡。然后取下烧杯把铁钉放入试管中,一段时间后,再把烧杯放回天平左盘,最后天平是否平衡? 。反应后试管内溶液的质量 (选填"增加"、"减少"或"不变")。
(2)如图乙,小妍将烧杯放在天平左盘,使天平重新平衡。然后倾斜烧杯使盐酸与石灰石粉末混合,一段时间后再把烧杯放回天平左盘,发现天平不再平衡。其原因是 。小柯对该实验装置进行改进,把烧杯换成锥形瓶(如图丙,装置气密性良好)。你认为能否验证质量守恒定律并阐述理由: 。
(3)小妍想测定实验所用石灰石中碳酸钙的质量分数,取6克石灰石粉末与足量的稀盐酸充分反应,反应后总质量减少2.2克。求石灰石中碳酸钙的质量分数(杂质与稀盐酸不反应)。(结果精确到0.1%)
某白色粉末,可能含有硫酸钠、硫酸铜、氯化钠、硝酸钡、碳酸钙中的一种或几种,某科学兴趣小组为探究其成分,设计了如下实验流程(所加试剂均足量)
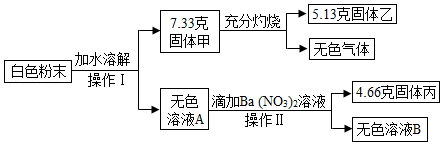
(1)操作Ⅰ、Ⅱ的名称是 ;
(2)无色气体的质量是 克;
(3)固体甲的成分是 ;
(4)这种白色粉末中一定不含有 ;
(5)求白色粉末中肯定含有的物质总质量。
徐州地区石灰石资源丰富。某化学兴趣小组称取4.0g石灰石样品,把40g稀盐酸分4次加入样品中(假设杂质不反应也不溶解),得实验数据如下:
稀盐酸的用量 |
剩余固体的质量 |
第一次加入10g |
3.0g |
第二次加入10g |
2.0g |
第三次加入10g |
l.0g |
笫四次加入10g |
0.6g |
请计算:
(1)4.0g石灰石样品中碳酸钙的质量是 g。
(2)10g稀盐酸能与 g碳酸钙正好完全反应。
(3)求稀盐酸的溶质质量分数(写出计算过程,结果精确到0.1% )。
牙膏中的摩擦剂可以增强牙膏对牙齿的摩擦作用和去污效果。已知某品牌牙膏中的摩擦剂是CaCO3和SiO2(SiO2不溶于水也不与稀盐酸反应)。为了测定摩擦剂中CaCO3的质量分数,通过实验测得如图数据:

(1)生成CO2质量为 g;
(2)求摩擦剂中CaCO3的质量分数。
试题篮
()