我国重载铁路加氢站今年投入了商业运营。机车加注 氢气做燃料,若用电解水的方法制取这些氢气,理论上需要水的质量是多少?(写出计算过程)
某兴趣小组用如图所示装置制取 ,加热混合物至不再产生气体后,称量试管中剩余固体的质量为 。请计算:
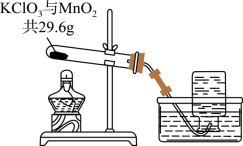
(1)生成 的质量为_____ 。
(2)剩余固体中 的质量分数。
化学兴趣小组对钢铁厂生产出来的某产品(只含铁和碳)产生好奇:它是生铁还是钢?该小组取 样品,加入到盛有足量稀硫酸的烧杯中,实验得到氢气的质量如下表。(提示:生铁的含碳量为 ,钢的含碳量为 )
|
时间/min |
0 |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
|
质量/g |
0 |
0.06 |
0.1 |
0.15 |
0.18 |
0.20 |
0.22 |
0.20 |
0.20 |
(1)分析判断:表格中第_____分钟的数据不合理;
(2)根据表格中合理的数据,在给出的坐标系上,画出氢气质量与时间的关系曲线:
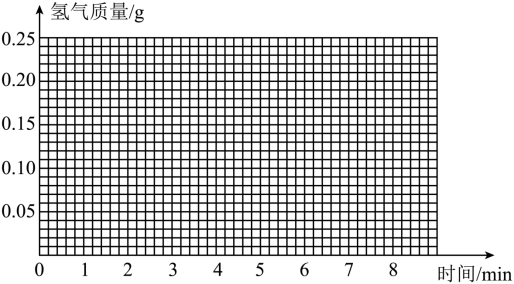
(3)通过计算判断该产品是生铁还是钢?(写出计算过程,计算结果保留到 )
为测定某实验废液中硫酸铜和硫酸的质量分数,分别在三只烧杯中倒入50g废液,并在烧杯中依次加入一定量的铁粉。实验结束后,测得的数据见如表:
|
第一组 |
第二组 |
第三组 |
|
|
反应前加入铁粉质量/g |
5.6 |
8.4 |
11.2 |
|
反应后剩余固体的质量/g |
3.2 |
3.2 |
6.0 |
|
反应后质量( )损失/g |
0.1 |
0.2 |
0.2 |
请回答:
(1)对比第一、二组数据,第一组实验结束后,废液中的 (填化学式)已全部参加反应;
(2)通过分析第二、三组数据,50g废液与铁粉反应生成氢气质量最多为 ;
(3)经计算,50g废液中所含硫酸的质量为 ,硫酸铜的质量分数为
我们在享受夏日阳光的同时还饱受蚊虫的侵扰。为此,不少家庭都备有杀虫剂,其中最常用的是气雾剂,这些气雾剂中往往含有二甲醚(化学式为 )。
请回答:
(1)二甲醚的相对分子质量为 ;
(2)二甲醚中 、 、 三种元素的质量比为 。

硫氧粉( )可用作染漂脱氧剂,常因氧化变质生成 。向20g可能被氧化的样品中,加入质量分数为10%的稀硫酸至恰好不再产生气泡(假设气体全部逸出),消耗稀硫酸98g。已知: 。
(1)根据化学式判断 和 中钠元素的质量分数较小的是 。
(2)若用5g质量分数为98%的浓硫酸配制10%的稀硫酸,求所需水的质量。
(3)求反应后溶液中溶质的质量分数。(精确到小数点后一位)
学习小组用已知浓度的氢氧化钠溶液测定某硫酸溶液的浓度。取该硫酸溶液20g,滴加10%的氢氧化钠溶液,恰好完全反应时,共消耗氢氧化钠溶液40g。计算:
(1)消耗的 溶液中溶质的质量为 g;
(2)该硫酸溶液的溶质质量分数。(温馨提示: )
“十四五”期间,我国将独立完成“天宫二号”空间实验室建造。建造舱段使用的新型铝基碳化硅复合材料是由颗粒状的铝和碳化硅( )复合而成的。
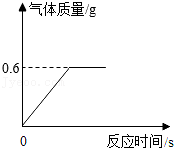
一位科技爱好者自研了一种铝基碳化硅复合材料,为了分析其中铝的质量分数,该科技爱好者取了10g样品溶于足量稀硫酸,所得实验数据如图所示。已知:碳化硅既不溶于水和酸,也不与二者反应。请回答下列问题:
(1)当样品中的铝完全反应时,生成的气体质量为 g。
(2)样品中铝的质量分数为多少?(写出完整解题过程)。
化学兴趣小组整理药品时,发现一瓶标签受损的稀盐酸。为测定该稀盐酸的溶质质量分数,同学们进行了如图的实验(所选石灰石中的杂质不溶于水,也不与其他物质反应;生成气体全部逸出)。

请完成下列问题:
(1)生成二氧化碳的质量为 g;
(2)计算稀盐酸的溶质质量分数(写出计算过程)。
医用碳酸氢钠片可用于治疗胃酸过多,某同学为测定其中碳酸氢钠的质量分数,取10.0g样品放入烧杯中,分两次加入稀盐酸(该实验条件下杂质不参与反应),充分反应。测定实验数据如表。
|
加盐酸的次数 |
第一次 |
第二次 |
|
加盐酸的质量g |
40.0 |
40.0 |
|
生成气体的质量/g |
3.3 |
1.1 |
(1)两次加稀盐酸后,生成二氧化碳的总质量是 g;
(2)该样品中碳酸氢钠的质量分数(写出计算过程)。(反应的化学方程式为: )
钾肥能增强植物抗倒伏能力,农民向土壤中施加草木灰,是因为草木灰中含碳酸钾(化学式为 )。
(1)碳酸钾中碳、氧元素的质量比 (最简整数比)。
(2)138g碳酸钾中钾元素质量为 g。
某造纸厂在造纸过程中会产生含氢氧化钠的废水,需经处理至中性后才能排放。现有5%的稀盐酸365kg,能处理废水中氢氧化钠的质量是多少?
我国科学家侯德榜发明了联合制碱法,为世界科学发展做出了重要贡献。该制碱法以食盐为原料制备纯碱,产品中会混有少量氯化钠。某学习小组为了探测产品中纯碱的质量分数,将5g纯碱样品溶于20g水中配成溶液,再加入30g氯化钙溶液恰好完全反应( ),反应后静置、过滤、洗涤、干燥,称得沉淀质量为4.5g。请回答下列问题:
(1)过滤后的滤液质量为 g。
(2)求纯碱样品中纯碱的质量分数。(写出计算过程)
盐酸是一种重要的化工原料,但在使用前一般需测定其中 的质量分数。现取200g未知溶质质量分数的盐酸溶液于锥形瓶中,然后向锥形瓶中滴加溶质质量分数为20%的氢氧化钠溶液至 (常温)时消耗氢氧化钠溶液200g,求盐酸中 的质量分数?
试题篮
()