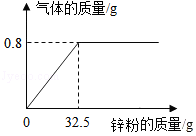
向一定量的稀硫酸中加入锌粉(仅含不溶于酸的杂质),所加锌粉的质量与产生气体的质量的关系如图所示。求:
(1)此过程中产生氢气的最大质量是 克。
(2)锌粉中锌的质量分数为多少。(请写出计算过程)
小华同学发现自家的水壶用久以后底部会附着一层白色固体,查阅资料后得知,水在加热或长久放置时,溶于水中的可溶性钙和镁的化合物会生成沉淀(水垢),于是他邀请同学小雪进行了以下实验探究。
探究一:自家的井水是软水还是硬水?
取少量井水样品于试管中,加入 ,振荡,出现大量浮渣,由此得出结论:自家的井水属于 。
探究二:白色固体的主要成分是什么?
[假设与猜想]猜想Ⅰ:CaCO3。
猜想Ⅱ: (填化学式)。
猜想Ⅲ:CaCO3和Mg(OH)2。
[实验与探究]取少量白色固体样品(不考虑杂质和微溶物对实验的影响)于试管中,向其中加入足量稀盐酸,白色固体溶解,有 产生,根据以上现象,小华认为:猜想Ⅰ正确。小雪认为小华的结论不严谨,理由是 。经过两人反复讨论,进一步设计了如下实验。
实验步骤 |
实验现象 |
实验结论 |
取上述实验中的上层清液于试管中,滴加足量NaOH溶液 |
无明显现象 |
猜想Ⅰ成立 |
|
猜想Ⅲ成立 |
[拓展与迁移]取含有MgCl2和HCl的混合溶液165.8g于烧杯中,向其中缓慢加入200g溶质质量分数为8%的NaOH溶液,恰好完全反应后过滤得到沉淀和滤液,其中滤液的质量为360g。请计算:
(1)生成沉淀的质量是 克。
(2)原混合溶液中,MgCl2的质量是多少?(请写出具体的计算过程,下同)
(3)恰好完全反应时,所得溶液的溶质质量分数是多少?(结果保留至0.1%)
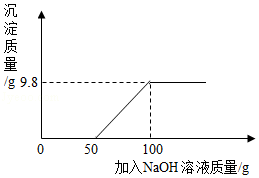
某学校化学实验室有一杯含盐酸和氯化铜的废液,该校化学兴趣小组的同学取109.8g废液于烧杯中,向其中逐滴加入一定溶质质量分数的氢氧化钠溶液,所加氢氧化钠溶液与生成沉淀的质量关系如图所示:
试计算:
(1)产生沉淀的总质量是 克;
(2)109.8g废液中氯化铜的质量是 克。
(3)计算加入100g氢氧化钠溶液并充分反应后烧杯内所得溶液中溶质的质量分数。
随着人类现代化程度迅速提高,温室气体(CO2)排放日益增加,为降低温室气体含量,科学家正在研究一种新型的“人造树叶”。假设每1升“人造树叶”每天可从空气中吸收二氧化碳880g并转化为乙醇(C2H5OH),对应化学方程式为2CO2+3H2O C2H5OH+3O2.请回答:
(1)写出该研究的一点意义 。
(2)若每天一棵树平均可吸收44g CO2,则一升“人造树叶”一天吸收的CO2相当于 棵树吸收的CO2。
(3)1升“人造树叶”工作一个月(按30天计)可得到乙醇多少克?(写出计算过程)。
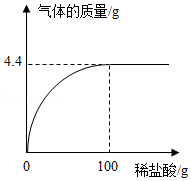
鸡蛋壳的主要成分是碳酸钙。某兴趣小组为了测定鸡蛋壳中CaCO3的含量,取12.5g干燥的鸡蛋壳,捣碎,放在烧杯中,然后向其中滴加某浓度的稀盐酸,滴加过程中产生气体质量与所加稀盐酸质量的关系如图所示(鸡蛋壳中除CaCO3外的其他成分都不溶于水,也不与稀盐酸反应)。试计算:
(1)产生CO2的质量为 g;
(2)该鸡蛋壳中CaCO3的质量分数;
(3)所用稀盐酸溶质的质量分数。
某化学兴趣小组利用如图装置进行Fe与水蒸气反应的实验:

(1)A装置的作用是 ,点燃C中产生的肥皂泡,有的发出轻微的爆鸣声,有的可以被点燃,请你推断反应生成的气体是 ;
(2)有同学认为导管口有气泡产生即说明反应生成了气体,你认为是否正确 (填“是”或“否”),请说明理由 ;
反应一段时间后,学习小组对反应后的黑色固体产生了浓厚的兴趣,并查阅了相关资料:铁粉(黑色),Fe2O3(红棕色)、FeO(黑色)、Fe3O4(黑色)。学习小组进行了一系列实验,验证了FeO不存在,然后对黑色固体的成分进行了以下猜想:
猜想一:只有铁粉
猜想二:只有Fe3O4
猜想三:铁粉和Fe3O4的混合物
学习小组设计了实验进行验证,请回答以下问题:
(3)取少量黑色粉末于试管中,加入足量的稀盐酸,有气泡产生,说明猜想 不成立;
(4)通过实验测得,34.4g黑色固体与足量的稀盐酸反应,产生了0.2g H2,说明猜想 成立;
(5)另取34.4g黑色固体在高温条件下与足量的CO反应,充分反应后,固体质量变为28.0g,请计算在黑色固体中Fe3O4的质量分数为 (计算结果精确到0.1%);
(6)根据以上探究,请写出Fe与水蒸气反应的化学方程式 。
向一定量的澄清石灰水中通入适量的二氧化碳,使氢氧化钙全部转化为碳酸钙沉淀,得到的沉淀质量为1.00g。计算澄清石灰水中氢氧化钙的质量(计算结果精确至0.01g)。
为测定某赤铁矿中Fe2O3的含量,取10g该赤铁矿样品于烧杯中,向其中加入100g稀盐酸,恰好完全反应,测得剩余固体的质量为2g。(杂质不溶于水也不与酸反应)
请完成下列分析及计算:
(1)10g样品中杂质的质量为 g。
(2)计算稀盐酸中溶质的质量分数。
农业生产上常用一定溶质质量分数的氯化钠溶液进行选种。实验小组取该溶液36g,向其中滴加硝酸银溶液至不再产生沉淀为止,过滤、洗涤、干燥后,用电子秤称得沉淀质量为14.35g。
(1)配制选种所用氯化钠溶液的步骤:计算、称量、 、溶解。
(2)计算该氯化钠溶液中溶质的质量分数(写出计算讨程)。
市售的某些银首饰是银、锌合金。小庆同学取该合金样品20g,加入100g稀硫酸恰好完全反应,产生气体质量与反应时间的关系如图所示,计算:
(1)该合金中锌的质量(精确到0.1g)。
(2)该稀硫酸中溶质的质量分数(精确到0.1%)。

某NaCl样品中只含有杂质CaCl2,为测定样品中CaCl2质量分数,取样品20g完全溶解于水中,并向其中加入过量的Na2CO3溶液,生成沉淀的质量是2g。计算样品中CaCl2的质量分数。
学习完金属的化学性质,同学们来到实验室进行锌、铜、银三种金属活动性顺序的探究活动。实验桌上老师提供的药品有:锌片、铜片、银片、硫酸锌溶液、硫酸铜溶液、硝酸银溶液和稀硫酸。
[制定计划]在老师的指导下,经过讨论,同学们设计出了以下几种实验方案:
方案一:铜片、硫酸锌溶液、硝酸银溶液;
方案二:锌片、银片、硫酸铜溶液;
方案三:锌片、铜片、硫酸铜溶液、硝酸银溶液;
你的设计方案是 。
[进行实验]小华同学选用方案三进行如下探究,请你帮他完成表格中的空白(注:表格中实验操作一栏用文字描述或图示表示均可):
实验操作 |
实验现象 |
分析与结论 |
|
。 |
金属活动性:Cu Ag(填“>”或“<”)。 |
|
锌片表面附着一层红色物质,溶液由蓝色逐渐变为无色。 |
金属活动性:Zn Cu(填“>”或“<”),反应的化学方程式为 。 |
[解释与结论]根据上述实验,小华得出三种金属活动性由强到弱的顺序是 。
[反思与评价]探究活动结束后,同学们分享自己的收获与不足,并进行反思:
1.有同学提出,小华的实验中不用硫酸铜溶液也能得到相同的实验结论。简要说明其验证方法: 。
2.经过讨论,大家一致认为以上实验方案中,方案 较好。
3.小华提出,试管中的金属可以回收再利用,这样做的意义是 。
[拓展与延伸]好奇地小华在老师的指导下,把一定量的锌粒加入硫酸铜和硝酸银的混合溶液中,充分反应一段时间后,过滤,发现滤液呈无色。此时,滤渣中一定含有 ,溶液中离子数目增加的是 。
了解常见物质重要的物理及化学性质,有利于我们系统地学习并应用知识解决问题。碱石灰是氧化钙和氢氧化钠固体的混合物,常用来干燥某些气体。某化学兴趣小组的同学对放置在空气中一段时间的碱石灰产生了探究兴趣。
[实验步骤]
步骤一:现将放置在空气中一段时间的碱石灰放入烧杯中,加足量水溶解,烧杯底部有白色沉淀生成;
步骤二:一段时间后过滤,取滤液,加入一定量的碳酸钠溶液,发现没有白色沉淀生成。
据此信息请你参与探究完成下列问题:
[实验探究]
(1)碱石灰中的氧化钙可做某些气体干燥剂的原因是 (用化学方程式表示)。
(2)步骤一向烧杯内的样品加足量的水溶解时,产生的白色沉淀是 。
[实验反思]
(3)固体氢氧化钠曝露在空气中,容易吸收空气中的水分而潮解;同时吸收空气中的 而变质,因此氢氧化钠固体必须密封保存。
(4)综合以上信息,向烧杯内的样品加足量的水溶解时,溶液中溶质组成的情况可能有 (有几种情况就写几种,用化学式表示)。
现有含氯化钠杂质的碳酸钠样品,取6.95g样品溶于水,配制成52.2g溶液。此溶液与50g某溶质质量分数的盐酸恰好完全反应,得到100g溶液。请分析计算:
(1)生成二氧化碳的质量是 。
(2)所得溶液中溶质的质量分数(写出计算过程)。
试题篮
()