某粉末中含有氧化铜和氧化亚铁,可能含有少量的氧化铁。为了从粉末中得到铜并判断是否含有氧化铁,设计下列装置进行实验(装置气密性良好,实验所需试剂足量)。

资料:1、无水氯化钙常用作干燥剂。
2、无水硫酸铜为白色粉末,吸水后变成蓝色固体。
3、氢气和金属氧化物加热反应生成金属单质和水。
(1)装置B中的试剂是 。从安全角度考虑,点燃酒精灯前,需要收集从装置E排出的气体并 。写出装置C中硬质玻璃管内反应的一个化学方程式 。
(2)加热,使粉末与通入的氢气充分反应:停止加热,持续通入氢气至固体冷却到室温。反应后从硬质玻璃管内的固体中得到铜的具体操作是 。判断原粉末中是否含有氧化铁。如果加热前只称量装置D的质量,则固体冷却到室温后还需要称量 ;利用以上数据,写出推断是否含有氧化铁的过程。
某小组发现实验室中盛放氧化钙的塑料瓶膨胀破裂。设计实验探究瓶中固体的成分。
步骤Ⅰ:取一定质量的固体平铺于试管中,通入足量水蒸气。一段时间后,将固体充分干燥并称量,质量不变。
步骤Ⅱ:另取等量固体于试管中,加水振荡,静置后观察到有白色沉淀。向试管中滴加酚酞试剂。上层清液变红。再加入稀盐酸,溶液由红色变为无色,有气泡产生,沉淀消失。
(1)用化学方程式表示塑料瓶膨胀破裂的主要原因 。
(2)由步骤Ⅰ推断固体中一定没有的物质是 。步骤Ⅱ最后所得溶液中溶质的可能组成是 (酚酞除外)。分析上述实验过程及现象,确定该固体的成分是 。
(3)上述实验中,通过测定某些量,还能确定固体中各成分的质量比。若选择加入一种过量的其它类别物质的溶液代替稀盐酸,也能达成此目的,加入的溶液是 ;确定该溶液过量,所选的试剂是 。
在实验室利用下列装置制取气体。

(1)仪器a的名称是 。用高锰酸钾制氧气的化学方程式为 ,选择的收集装置是 (填字母,下同)。
(2)用大理石和稀盐酸制二氧化碳的化学方程式为 ,选择的发生装置是 。用装置D收集二氧化碳时,可用 验满。
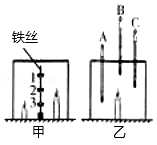
某同学用相同的两个玻璃罩探究蜡烛(主要含碳、氢元素)在其中的燃烧情况。
实验Ⅰ:如图甲,将三个盛有等量澄清石灰水的敞口容器编号,并等距离固定在铁丝上。在铁丝两侧点燃高、低两支蜡烛,立即用玻璃罩扣上,使铁丝处于正中位置。三个容器内石灰水变浑浊所需的时间如表格所示。
容器编号 |
1 |
2 |
3 |
时间/秒 |
3.2 |
5.0 |
11.1 |
实验Ⅱ:如图乙,将三支温度计的玻璃泡分别置于玻璃罩内的不同位置。点燃蜡烛,一段时间后,观察到B的示数明显增大,A、C示数增大不明显。
(1)根据表中数据,推测实验Ⅰ中,先熄灭的是 (填“高”或“低”)蜡烛。
(2)通过上述实验,解释1号容器内澄清石灰水先变浑浊的原因 。
(3)结合实验及相关知识分析,高层楼房着火时,一般情况下,合理的做法有 (可多选)。
A.排队乘电梯依次撤离
B.向着火楼层的上方撤离
C.用湿毛巾捂住口鼻,弯腰跑离火场
D.若火势不大,可用灭火器材将火扑灭
实验室用34g过氧化氢溶液和2g二氧化锰混合制取氧气。完全反应后剩余物质总质量为35.2g。请计算:
(1)生成氧气的质量为 g。
(2)求所用过氧化氢溶液溶质的质量分数。(根据化学方程式进行计算,写出计算过程)
糖类是人体的六大基本营养素之一,能为人体提供能量,其中蔗糖是储存在某些植物(如甘蔗、甜菜等)中的糖,化学式为C12H22O11,请完成下列问题:
(1)蔗糖属于 (填“无机物”或“有机物”)。
(2)蔗糖中碳、氧、氢元素的质量比为 (填最简整数比)。
学校化学兴趣小组的同学对酸碱中和反应进行探究:
[提出问题]氢氧化钠与盐酸能否发生反应?
[查阅资料]NaCl溶液显中性。
[进行实验]甲、乙两组同学分别进行实验,甲组同学先向试管中加入约2mL氢氧化钠溶液,再滴入酚酞溶液,溶液变红,然后逐滴滴入稀盐酸,边滴加边振荡,直到溶液恰好变为无色。
[实验结论]氢氧化钠与盐酸 能 (填"能"或"不能")发生反应。
[发现问题]乙组同学在滴入稀盐酸的过程中,观察到有气泡产生,所以确定本组所用氢氧化钠溶液已变质,其变质的原因是 (用化学方程式表示)。
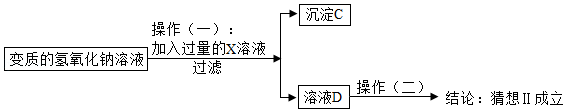
[猜想与假设]同学们对变质的氢氧化钠溶液的溶质成分进行探究。
猜想Ⅰ:只有碳酸钠
猜想Ⅱ:
[查阅资料]CaCl 2溶液、Ca(NO 3) 2溶液都呈中性。
[进行实验]实验过程如图:
回答下列问题:
(1)适合操作(一)的X溶液是 。
A.Ca(OH) 2溶液
B.CaCl 2溶液
C.Ba(OH) 2溶液
(2)根据(1)中所选的X溶液,生成沉淀C的化学方程式为 。
(3)过滤操作中玻璃棒的作用是 。
(4)操作(二)可以为:取少许溶液D于试管中,滴加酚酞溶液,若溶液 则猜想Ⅱ成立。
[实验反思]通过本实验同学们认识到,氢氧化钠溶液必须 保存。
根据如图装置,结合所学化学知识回答问题。

(1)图中仪器①名称是 。
(2)实验室可以用装置B和C的组合制取二氧化碳气体,所用药品是石灰石和 ,可以用盛有澄清石灰水的F装置检验二氧化碳气体,气体应从 端通入。
(3)若用A装置制取氧气,发生反应的化学方程式为 。用装置E收集氧气时,当 时,说明氧气已经集满。
84消毒液的有效成分是次氯酸钠(NaClO),次氯酸钠工业制法的反应原理是:Cl 2+2NaOH═NaClO+NaCl+H 2O.某同学将Cl 2通入185.8g NaOH溶液中(NaOH过量),充分反应后得到混合溶液200g。计算:(计算结果精确到0.1%)
(1)参加反应的氯气质量是 g。
(2)混合溶液中次氯酸钠的质量分数。
(3)84消毒液中起消毒作用的是次氯酸钠中的氯元素。已知某品牌84消毒液中起消毒作用的氯元素质量分数为6%,计算该84消毒液中次氯酸钠的质量分数。
化学规律建立在实验基础之上,质量守恒定律可以用许多化学实验加以验证。
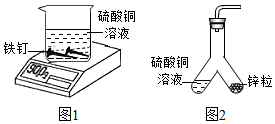
(1)小东同学按照课本上的实验进行验证(如图1所示)。一段时间后,可以观察到铁钉表面出现 ,其反应的化学反应方程式为 ,反应前后天平读数不变,但溶液颜色变化不明显。
(2)小东想既能验证质量守恒定律,又能更快地观察到溶液颜色的变化,提出了以下设想:
【提出设想】设想一:增大硫酸铜溶液的浓度
设想二:用更活泼的金属锌代替铁钉
【实验验证】小东将以上实验进行了如下改进:
实验内容 |
实验现象 |
|
实验1 |
烧杯中换成饱和硫酸铜溶液 |
①1小时后溶液颜色几乎不变 ②天平读数不变 ③铁钉表面有变化 |
实验2 |
铁钉换成锌粒 |
①溶液颜色明显变浅 ②天平读数减小 ③锌粒表面有变化 |
【实验分析】从以上现象分析,两个设想都不合适,其中按设想 (填“一”或“二”)进行的实验能够验证质量守恒定律。
实验1中溶液颜色几乎不变的原因可能是 (填序号)。
A.铁与饱和硫酸铜溶液不反应
B.铁表面形成了一层氧化膜,阻止了反应的进一步进行
C.生成的铜快速沉积在铁表面,阻止了反应的进一步进行
D.水也参与了该反应,但饱和硫酸铜溶液中水太少
实验2虽然很快观察到溶液颜色变化,但出现了反应后总质量减小的情况,老师提醒小东,硫酸铜溶液呈酸性,所以总质量减小的原因可能是 。
(3)小东通过反复实验和探究得出:向实验1的饱和硫酸铜溶液中加入等体积的水,将实验2中的烧杯换成如图2所示装置,均能达到实验目的,但该装置中缺少一种物品,请你在装置图中画出。
过氧化氢溶液俗称双氧水,是一种常见消毒剂。实验员用以下方法制取了少量过氧化氢溶液,在低温下,向56.4g某浓度的稀硫酸中逐渐加入一定量的过氧化钡(BaO 2),发生的化学反应为BaO 2+H 2SO 4═BaSO 4↓+H 2O 2,当恰好完全反应时生成23.3g沉淀。计算:
解:(1)设加入BaO 2的质量为X,生成的H 2O 2质量为Y,需要加入水的质量为Z
BaO 2 +H 2SO 4 ═BaSO 4↓+H 2O 2
169 233 34
X 23.3g Y
X=16.9g;Y=3.4g
(2)反应后所得溶液中溶质质量分数为: 6.8%;
(3)设需加入水的质量为Z
(16.9g+56.4g﹣23.3g)×6.8%=(16.9g+56.4g﹣23.3g+Z)×3%
Z=63.3g
答:(1)加入BaO 2的质量是16.9g;
(2)反应后所得溶液中溶质质量分数6.8%;
(3)需加入水的质量63.3g。
学习复分解反应发生条件时,小红同学做了如下表中的四个实验。
试管编号 |
① |
② |
③ |
④ |
试管内试剂 |
NaOH溶液 |
MgCl2溶液 |
Na2CO3溶液 |
Ba(NO3)2溶液 |
加入稀硫酸后的现象 |
无明显现象 |
无明显现象 |
产生气泡 |
白色沉淀生成 |
(1)根据以上实验,可以判断试管③④中发生了复分解反应。试管③中反应的化学方程式为 。
(2)小明同学向盛有NaOH溶液的试管中先加了一种试剂,再加稀硫酸,从而能说明试管①中也发生了反应,这种试剂是 。
(3)为了验证试管②中是否发生复分解反应,小明同学进行了如下探究。
[提出猜想]猜想1:试管②中没有发生复分解反应,溶液中有MgCl2,即Mg2+和Cl﹣同时存在溶液中。
猜想2:试管②中发生了复分解反应,溶液中无MgCl2。
老师提示SO42﹣会对Cl﹣的检验有干扰,需要先除去,小明根据老师的提示和自己的猜想提出了如图实验方案。
[设计方案]

沉淀A的化学式是 。老师评价该方案时指出:设计思路正确,但试剂选择有误,你认为应该将所选的试剂 改成 。小明按照修改后的方案进行了实验,最后得出的结论是猜想1正确,则步骤Ⅱ、步骤Ⅲ中必然会观察到的现象是 。
[实验反思]小明反思进行步骤Ⅲ时,加NaOH溶液采用了滴加的方式,但没有立即观察到任何现象,你认为其中的原因是 。
在100g的某盐酸中加入硝酸银溶液,反应为AgNO3+HCl═HNO3+AgCl↓,至恰好完全反应,经过滤、洗涤、干燥、称量得到质量为28.7g的AgCl沉淀,求盐酸的溶质质量分数。
不用火,不用电,只需拆开发热包倒入凉水,就能享用美食的自热食品,受到消费者的追捧。

[查阅资料]Ⅰ.发热包中物质的主要成分是生石灰、碳酸钠、铝粉。
Ⅱ.铝和强碱溶液反应生成氢气。
探究一:发热包的发热原理
(1)小明买了一盒自热米饭,取出发热包加入凉水,发生剧烈反应,迅速放出大量的热,写出产生该现象的主要化学反应方程式 ;同时发热包内固体物质变硬、结块。依据观察到的实验现象,小明猜想发热包内的物质可能发生多个化学反应,写出其中一个反应的化学方程式 。
(2)发热包上的安全警示图标有“禁止明火”,其原因可能是 。
(3)小明向使用后的发热包中加入稀盐酸,并对产生的气体展开进一步探究。
探究二:确定气体的成分
[猜想与假设]小明认为该气体可能是:a.H2; b. ; c.CO2和H2的混合气体。
[实验设计]小明同学设计如图实验装置,对气体成分进行探究。
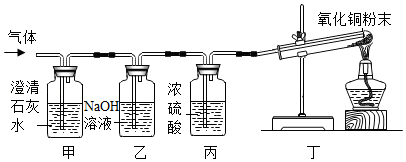
[实验验证]甲装置中的实验现象是 ,丁装置中黑色的粉末逐渐变为红色,试管口有水珠产生,证明猜想c正确。若甲、乙装置交换位置, (填“能”或“不能”)确定气体中含有CO2,写出化学方程式并说明理由 。
[总结与反思]通过以上探究,小明做出如下反思:
A.发热包应密封防潮保存
B.能与水混合放出热量的物质均可做发热包的发热材料
C.使用后的发热包应包好按照垃圾分类投放
你认为其中正确的是 。
试题篮
()