实验室用34g过氧化氢溶液和2g二氧化锰混合制取氧气。完全反应后剩余物质总质量为35.2g。请计算:
(1)生成氧气的质量为 g。
(2)求所用过氧化氢溶液溶质的质量分数。(根据化学方程式进行计算,写出计算过程)
84消毒液的有效成分是次氯酸钠(NaClO),次氯酸钠工业制法的反应原理是:Cl 2+2NaOH═NaClO+NaCl+H 2O.某同学将Cl 2通入185.8g NaOH溶液中(NaOH过量),充分反应后得到混合溶液200g。计算:(计算结果精确到0.1%)
(1)参加反应的氯气质量是 g。
(2)混合溶液中次氯酸钠的质量分数。
(3)84消毒液中起消毒作用的是次氯酸钠中的氯元素。已知某品牌84消毒液中起消毒作用的氯元素质量分数为6%,计算该84消毒液中次氯酸钠的质量分数。
"84消毒液"是一种常用含氯消毒用品,有效成分是次氯酸钠(NaClO)。使用时,可根据实际需求进行配比,并规范使用,以防引发危险。
(1)"84消毒液"中的有效氯来自次氯酸钠,计算次氯酸钠中氯元素的质量分数。(计算结果精确到0.1%)
(2)现需要5L有效氯浓度为500mg/L的稀溶液,选用有效氯浓度为50000mg/L的某品牌"84消毒液"进行配制,需加水多少升?( 忽略混合前后溶液体积的变化)
(3)"84消毒液"不能与洁厕灵混合使用,因为"84消毒液"里的次氯酸钠与洁厕灵里的盐酸会发生化学反应,产生的氯气对人体有害,不同浓度氯气对人体的影响如表所示。
| 浓度(mg/m 3) |
对人体的影响 |
| 3000 |
可立即麻痹呼吸中枢,导致瞬间死亡 |
| 120﹣170 |
极为危险,会引起急性肺水肿及肺炎 |
| 40﹣60 |
在1小时内便可致人严重中毒 |
通过计算分析,在10米 3密闭空间里,若将1.49克次氯酸钠与盐酸完全反应,产生的氯气会对人体造成怎样的影响?(次氯酸钠与盐酸反应的化学方程式为:NaClO+2HCl═NaCl+Cl 2↑+H 2O)
过氧化氢溶液俗称双氧水,是一种常见消毒剂。实验员用以下方法制取了少量过氧化氢溶液,在低温下,向56.4g某浓度的稀硫酸中逐渐加入一定量的过氧化钡(BaO 2),发生的化学反应为BaO 2+H 2SO 4═BaSO 4↓+H 2O 2,当恰好完全反应时生成23.3g沉淀。计算:
解:(1)设加入BaO 2的质量为X,生成的H 2O 2质量为Y,需要加入水的质量为Z
BaO 2 +H 2SO 4 ═BaSO 4↓+H 2O 2
169 233 34
X 23.3g Y
X=16.9g;Y=3.4g
(2)反应后所得溶液中溶质质量分数为: 6.8%;
(3)设需加入水的质量为Z
(16.9g+56.4g﹣23.3g)×6.8%=(16.9g+56.4g﹣23.3g+Z)×3%
Z=63.3g
答:(1)加入BaO 2的质量是16.9g;
(2)反应后所得溶液中溶质质量分数6.8%;
(3)需加入水的质量63.3g。
某化学小组初步探究氢氧化钠的性质、变化和获得方法。
查阅相关资料:
Ⅰ.部分酸、碱和盐的溶解性表(室温)
| 阴离子/阳离子 |
OH ﹣ |
NO 3 ﹣ |
Cl ﹣ |
SO 4 2 ﹣ |
CO 3 2 ﹣ |
| H + |
|
溶、挥 |
溶、挥 |
溶 |
溶、挥 |
| K + |
★溶 |
溶 |
溶 |
溶 |
溶 |
| Na + |
溶 |
溶 |
溶 |
溶 |
溶 |
| Ca 2+ |
微 |
溶 |
溶 |
微 |
不 |
| Cu 2+ |
不 |
溶 |
溶 |
溶 |
﹣﹣ |
说明:"溶"表示那种物质可溶于水,"不"表示不溶于水,"微"表示微溶于水,"挥"表示挥发性,"﹣"表示那种物质不存在或遇到水就分解了。
Ⅱ.氢氧化钠的工业制法:电解氯化钠饱和溶液
2NaCl+2H 2O 2NaOH+H 2↑+Cl 2↑
[性质与变化]
(1)上表★处"溶"对应的物质是 。
(2)完成下列物质转化,各写出一个符合要求的化学方程式。
①  。
。
②  。
。
[实践与应用]工业上常用电解氯化钠饱和溶液的方法生产氢氧化钠
(3)某化工厂计划生产16t氢氧化钠,请计算:
①氢氧化钠的相对分子质量是 。
②理论上需要氯化钠的质量是 t。
(4)工业生产中可制得含NaOH溶质质量分数约为45%的液碱产品,经进一步处理还可以制得固体氢氧化钠产品。请根据已有知识,对"进一步处理"中使用的方法提出设想并简要说明理由。
(5)工业固体氢氧化钠质量指标如图所示,请对产品中的杂质来源作出合理分析。
| 工业固体氢氧化钠质量指标 (合格品) 氢氧化钠(NaOH)/%≥98.0 碳酸钠(Na 2CO 3)/%≤1.0 氯化钠(NaCl)/%≤0.08 |
碳酸钠: 。
氯化钠: 。
取一定量的硫酸铵固体于烧杯中,加入100g氢氧化钠溶液,加热,恰好完全反应。反应后将溶液蒸干,得到7.1g固体。该反应的化学方程式为:(NH4)2SO4+2NaOH═Na2SO4+2H2O+2NH3↑.请计算:
(1)生成氨气的质量。
(2)氢氧化钠溶液中溶质的质量分数。
化学兴趣小组要测定制作叶脉书签所用氢氧化钠溶液的浓度。取40g该氢氧化钠溶液于锥形瓶中,加入数滴酚酞溶液后再滴加质量分数为10%的稀硫酸,当锥形瓶中液体由红色恰好变成无色时,消耗稀硫酸的质量为49g。试计算该氢氧化钠溶液中溶质的质量分数。
在100g的某盐酸中加入硝酸银溶液,反应为AgNO3+HCl═HNO3+AgCl↓,至恰好完全反应,经过滤、洗涤、干燥、称量得到质量为28.7g的AgCl沉淀,求盐酸的溶质质量分数。
洁厕灵是常用的陶瓷清洗液,某同学对某品牌洁厕灵的有效成分含量进行探究。向一锥形瓶中加入100g该品牌的洁厕灵,再加入足量的溶质质量分数为8%的NaHCO3溶液120g,反应结束后溶液的总质量是215.6g。试计算下列问题:
[知识卡片]洁厕灵有效成分是HCl,洁厕灵中其它成分均不跟NaHCO3反应。
(1)产生的二氧化碳质量为 克。
(2)该品牌洁厕灵中HCl的质量分数是多少?(写出计算过程。)
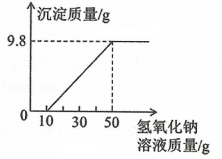
实验室有一瓶久置的氢氧化钠固体,经检验只含有NaOH和Na2CO3两种物质。现取该固体样品12.5g溶于水配制成溶液。然后向溶液中滴加稀硫酸,同时收集反应产生的气体。当溶液中的溶质恰好全部转化成Na2SO4时,立即停止滴加稀硫酸。将产生的气体干燥后测定其质量为2.2g(假定溶液中无气体残留)。回答下列有关问题:
(1)写出碳酸钠与硫酸反应的化学方程式: 。
(2)氢氧化钠固体样品中NaOH的质量为 。
(3)计算所加稀硫酸的体积(稀硫酸的溶质质量分数为40%,密度为1.3g/cm3)。
[要求:第(3)小题写出计算过程且计算结果保留到小数点后1位]
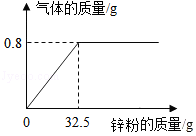
向一定量的稀硫酸中加入锌粉(仅含不溶于酸的杂质),所加锌粉的质量与产生气体的质量的关系如图所示。求:
(1)此过程中产生氢气的最大质量是 克。
(2)锌粉中锌的质量分数为多少。(请写出计算过程)
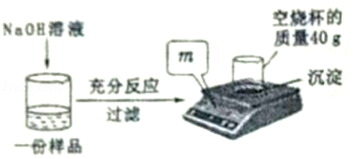
向盛有100g稀硫酸和硫酸铜混合溶液的烧杯中滴加氢氧化钠溶液至过量,过滤、烘干并称量沉淀的质量。该反应过程如图所示。请按要求回答问题:
(1)滤液中的溶质是 (填化学式)。
(2)计算原混合溶液中硫酸铜的质量。
(3)氢氧化钠溶液的溶质质量分数。
某兴趣小组取CaCO 3和CaCl 2的固体混合物7.5g,加入到盛有一定质量某浓度稀盐酸的烧杯中,恰好完全反应,气体全部逸出后,所得不饱和溶液的质量为41.8g。
烧杯及烧杯内物质质量随反应时间变化如表。
| 反应时间 |
0 |
t 1 |
t 2 |
t 3 |
| 烧杯及烧杯内物质质量 |
64 |
62.9 |
61.8 |
61.8 |
计算:
(1)生成CO 2的质量为 g。
(2)烧杯中原有稀盐酸的溶质质量分数是多少?
为测定某CuSO 4溶液中溶质的质量分数,取150g CuSO 4溶液,平均分为三份,每份样品均按如图所示进行实验,实验数据见表。请计算:
| |
实验1 |
实验2 |
实验3 |
| 样品质量/g |
50 |
50 |
50 |
| NaOH溶液质量/g |
20 |
40 |
60 |
| m/g |
44.9 |
49.8 |
49.8 |
(1)50g CuSO 4溶液完全反应时,所得沉淀的质量为 g。
(2)CuSO 4溶液中溶质的质量分数。
市场上常见的苏打水有苏打气泡水和无汽苏打水两种。它们的主要成分中都含有碳酸氢钠,俗称小苏打,具有以下性质。
性质一:2NaHCO 3  Na 2CO 3+H 2O+CO 2↑(NaHCO 3在50℃以上开始逐渐分解)
Na 2CO 3+H 2O+CO 2↑(NaHCO 3在50℃以上开始逐渐分解)
性质二:NaHCO 3+HCl═NaCl+H 2O+CO 2↑
(1)苏打气泡水中含有大量二氧化碳,瓶盖一打开就有大量气泡产生,所以叫气泡水。无汽苏打水则不含二氧化碳,但小明认为他喝入体内也会产生二氧化碳,主要是利用了碳酸氢钠的性质 (选填"一"或"二"),理由是 。
(2)小明查阅了相关资料想自制苏打水,于是购买了一袋小苏打,包装袋上标注的碳酸氢钠含量是99%。真的有这么高吗?小明取了10克小苏打样品放入装置,逐次加入稀硫酸进行实验,得到相关数据。请通过计算帮助小明判断包装袋上的标注是否准确。(2NaHCO 3+H 2SO 4═Na 2SO 4+2H 2O+2CO 2↑)

| 序号 |
反应前 |
第1次 |
第2次 |
第3次 |
第4次 |
第5次 |
| 加入稀硫酸溶液质量/克 |
0 |
10 |
10 |
10 |
10 |
10 |
| C装置中溶液总质量/克 |
100.0 |
101.1 |
102.2 |
103.3 |
104.4 |
105.0 |
(3)如果去掉装置B,测量结果将会 (选填"偏大"或"偏小")。
试题篮
()