比较与分析归纳会使你变得更聪明。请分析下表中信息,回答有关问题:
| 名称 |
符号 |
原子结构示意图 |
单质的 化学式 |
常温常压下 状态 |
单质与氢气反应 |
| 氟 |
F |
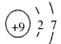 |
F2 |
气态 |
黑暗处爆炸 |
| 氯 |
Cl |
 |
Cl2 |
气态 |
光照爆炸 |
| 溴 |
Br |
 |
Br2 |
液态 |
加热反应 |
| 碘 |
I |
 [ [ |
I2 |
固态 |
持续加热缓慢反应 |
⑴上述表中X=
⑵①试归纳氟、氯、溴、碘的原子结构规律(答一点即可):
;
②试归纳氟、氯、溴、碘对应单质的性质变化规律(答一点即可):
;
⑶已知:Cl2和Br2的化学性质相似,Cl2+H2O=HCl+HClO,其中HClO也是一种酸,它与氢氧化钠溶液反应的反应方程式为:HClO+NaOH=NaClO+H2O,试分别写出Br2与水,Br2与NaOH溶液反应的化学方程式:
;
。
下列用字母表示的8种物质由H、C、O、Ca、Cl、Mn中的几种元素组成,它们是初中化学常见的物质。
(1) A遇B溶液产生气泡,产物中甲和乙常作灭火剂,该反应的化学方程式为 。
(2)C与甲组成元素相同。C在空气中燃烧生成甲,该化学方程式为 。
(3)D与乙组成元素相同。D在丙的帮助下分解生成乙,则丙的名称 ,该反应的化学方程式为 。
某学生兴趣小组想利用废铜线制氢氧化铜。他们设计流程图如下:
(1) 写出图中编号物质或其溶质的化学式:A_________B_________;
(2)写出①发生反应的化学方程式____________________________________________;
(3 ) 写出②所用的分离方法:_______________________。
(3分)有科学家提出回收利用空气中CO2的构想:把空气吹入饱和碳酸钾溶液中, 溶液可吸收CO2生成碳酸氢钾;加热该溶液使之又分解出CO2,使其在合成塔内与氢气反应生成甲醇(CH3OH)和水。简要的生产流程如下图所示:
(说明:吸收池中盛有饱和的K2CO3溶液,合成塔内的反应条件为300℃、200 kPa和催化剂)
(1)合成塔中发生反应的化学方程式。
(2)请在图中标出可循环利用的物质名称和循环方向。
(3)若空气不经吸收池和分解池而直接通入合成塔,你认为可行吗?请简述原因。
在学习完蜡烛燃烧的探究实验后,壮壮同学回到家中又进行了一下实践活动:
(1)点燃一支蜡烛,在火焰上方放一个冷碟子(如图),过一会儿,发现冷碟子底上有黑色物质,这种黑色物质是.

(2)石蜡主要由碳、氢元素组成.根据石蜡的组成元素说出黑色物质是怎样产生的
(3)用一个大玻璃管罩住燃着的蜡烛,过一会儿蜡烛熄灭.这种熄灭蜡烛的方法体现的灭火原理是什么?
在化学反应前后,物质的总质量会发生变化吗?针对此问题,
小王同学通过下面的实验进行探究。
[猜想假设] 猜想1:化学反应前后物质的总质量增大;猜想2:化学反应
前后物质的总质量 ;猜想3:化学反应前后物质的总质量_______。
[设计实验]到底哪种猜想正确?小王想设计了下面的实验进行探究。
实验:用热的玻璃棒点燃白磷,使其燃烧,测定反应前后物质的质量变化。
[实验现象] 白磷燃烧产生________;气球先变大,后又变小。天平最后
仍平衡。
[实验反思] ⑴实验中气球先变大,后又变小的原因是_____________________
。
小王根据该实验现象,再结合前面所学的碳酸钙和盐酸反应前后的质量变化情况的实验探究得出了下列结论:当用有气体参加或生成的化学反应来验证质量守恒定律时,应在 ,才能判定参加化学反应的反应物总质量和生成物总质量是否相等。
某活动小组用废铜制取硫酸铜溶液,实验过程为:
⑴废铜在空气中加热后得到的氧化铜中含有少量铜,原因是________(填字母序号)。
a.加热时氧化铜易分解生成铜
b.铜与氧气没有完全反应
c.加热时铜不能与氧气反应
⑵操作Ⅰ的名称是 ,该操作用到的玻璃仪器有:玻璃棒、烧杯、 。
⑶盛放硫酸铜溶液不宜用铁制容器的原因是(用化学方程式解释) 。
⑷向AgNO3和Cu(NO3)2的混合溶液中加入一定量的铁粉,充分反应后过滤,向滤渣中加入稀盐酸,无气泡产生。根据上述现象可得,滤渣中一定含有 。
如图所示,某同学在进行酸碱中和反应的实验时,向烧杯中的氢氧化钠溶液滴加稀盐酸一会儿后,发现忘记了滴加指示剂。为了确定盐酸与氢氧化钠是否恰好完全反应,她从烧杯中取了少量反应后的溶液于一支试管中,并向试管中 滴加几滴无色酚酞试液.振荡.观察到酚酞试液不变色。于是 她得出“两种物质已恰好完全中和”的结论。
(1)你认为她得出的结论是 的(填“正确”或“错误”),理由是
(2)请你设计一个实验.探究上述烧杯中的溶液是否恰好完全中和。 请填写下表:
如图是
、
、
三种物质的溶解度曲线,请据图回答:

(1)
℃时,
、
、
三种物质的溶解度由大到小的顺序是(填序号,下同);
(2)
℃时,将100
物质加入到100
水中并充分搅拌,形成溶液的质量为
;
(3)将℃时
、
、
三种物质的饱和溶液降低温度到
℃时,这三种溶液中溶质质量分数的大小关系是.
某同学在学习溶液的酸碱性时发现盐溶液
呈中性
溶液呈碱性,该同学认为有可能有的盐溶液会呈酸性,上网查资料发现
,
溶液呈酸性.该同学来兴趣了写出如下的学习小结,请你做一做:
(1)盐溶液
的可能为(将你的假设填入空格中)①②③
=7
(2)要测定该溶液的酸碱性用,如要知道该溶液的酸碱度可用.操作方法.
(3)"庄稼一枝花,全靠肥当家."
是一种氮肥能促进农作物的茎、叶生长茂盛,能使紫色石蕊试液变色.
(4)铵态氮肥的检测方法是:.
(5)该同学加热
溶液发现有红褐色沉淀生成,请写出化学方程式:.(提示:
等难溶性碱在
>5盐酸中不溶解)
(6)为什么
溶液呈碱性,
,
溶液呈酸性,上网查不是很明白,是高中要学的,等上高中后我一定要搞清楚.
除
样品中少量的
和
杂质,根据提供的试剂:
溶液、稀盐酸、
溶液分析并成下列有关问题:
(1)第一步:取
样品溶于水。加入过量的试剂,完全反应后,过滤,除去
杂质;所发生的化学反应方程式是.
(2)第二步:在第一步所得滤液中加入适量的试剂,完全反应后,再过滤,除去样品中杂质;
(3)第三步:在第二步所得滤液中加足量的稀
,完全反应后,再进行操作,最后得到
晶体。
有三种白色粉末.分别是碳酸钡、硫酸钡和碳酸钠。请设计一个实验方案.把这三种粉末区分开来。叙述实验操作、预期现象和结论。
(实验室仅提供了稀
、
溶液、蒸馏水以及常用的实验仪器。)
| 实验操作 |
预期现象与结论 |
能源“非石油化”是战略目标,发展以CH4、CO2等为原料的“C1化学”成为当今化工生产的必然趋势。通常天然气中含有H2S等有毒气体,下图为天然气合成氨的工艺流程。
(1)合成氨的原料之一为氮气,该流程中为合成氨提供氮气的物质是 。
(2)①处加入Fe2O3·H2O的目的是 。
(3)③处一般加入K2CO3溶液以吸收CO2 ,K2CO3溶液与CO2反应生成碳酸氢钾(KHCO3),该反应的化学方程式是 。
(4)右图是实验室模拟合成氨气的装置

(反应方程式:N2+3H2=2NH3)甲装置的作用有三个:一是将氮气和氢气干燥;二是使氮气和氢气充分混合;三是 ,从而提高氮气和氢气的利用率。
(5)该流程中参与循环的物质是 。
有三种白色粉末,分别是碳酸钡、硫酸钡和碳酸钠。请设计一个实验方案,把这三种粉末区分开来,请叙述实验操作、预期现象和结论。(实验室仅提供了稀HCl、Na2SO4溶液、蒸馏水以及常用的实验仪器)
请根据图示回答问题:

(1)当适量的液体A和气体B是下列哪种组合时,打开
弹簧夹试管中的水会重新沸腾 ;
| A.水和氧气 | B.氢氧化钠溶液和二氧化硫 |
| C.酒精和氮气 | D.氯化钙溶液和一氧化碳 |
(2)请用理化知识解释试管中的水重新沸腾的原因
试题篮
()