小科为测定某石灰石样品(主要成分为碳酸钙,其它成分不与稀盐酸反应)中碳酸钙的含量,利用气密性良好的图甲装置进行实验:①称取石灰石样品6克,加入锥形瓶中,塞紧瓶塞,从左侧持续缓慢鼓入空气;②一段时间后打开分液漏斗活塞,注入足量的稀盐酸,开始计时;③待装置D总质量不再增加时停止鼓入空气。实验过程中测得装置D增加的质量随时间变化图象如图乙。(碱石灰能吸收二氧化碳和水) 
(1)根据图乙,运用化学方程式计算该石灰石样品中碳酸钙的质量分数。(计算结果精确到0.1%)
(2)下列情况中,会导致测得的碳酸钙质量分数偏大的是 。
①去掉装置A,将空气直接鼓入装置B
②去掉装置C,将B与D装置直接相连
③当气泡停止产生时立即停止鼓入空气
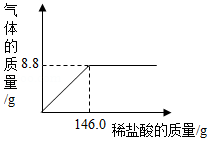
为了节约林木资源,近几年兴起了一种含碳酸钙的“石头纸”,这种“石头纸”是用沿海水产养殖中大量废弃贝壳制得的,为测定其中碳酸钙(杂质不溶于水也不与水反应)的含量。某校化学兴趣小组的同学进行了如下实验(水和氯化氢的挥发忽略不计);取25.0g样品粉碎放入烧杯中,加入一定质量分数的稀盐酸,所加稀盐酸的质量与生成气体的所量关系如图所示:
(1)计算“石头纸”中碳酸钙的质量分数。
(2)完全反应后烧杯内溶液的溶质的质量分数是多少?(结果精确到0.1%)
工业上制作电路的一种反应原理是Cu+2HCl+H2O2 CuCl2+2H2O.若反应了6.4g Cu,计算需要10%的H2O2溶液的质量。
实验室固体氢氧化钠敞口放置在空气中容易变质而失效,现称取该久置于空气中的烧碱样品10.6g完全溶于蒸馏水中配成100g溶液,向其中滴加质量分数为3.7%的氢氧化钙溶液,产生沉淀与所加氢氧化钙溶液的质量关系如图所示。请通过计算回答:
(1)该烧碱样品变质的程度为 (填"部分变质"或"全部变质")。
(2)m= g。
(3)当沉淀刚好达到最大质量时,溶液中溶质质量分数为多少?(写出计算过程,计算结果精确到0.01%)

碱式碳酸铜是孔雀石的主要成分,俗称铜绿,化学式为Cu2(OH)2CO3,受热可分解生成CuO、水和二氧化碳。
(1)碱式碳酸铜的相对分子质量是 。
(2)铜绿分解生成22g的二氧化碳的同时,生成CuO的质量是多少?
改革开放以来,我国钢铁工业飞速发展,近年来钢铁产量已稳居世界首位。某钢铁厂采用赤铁矿(主要成分为Fe 2O 3)炼铁,反应原理为Fe 2O 3+3CO 2Fe+3CO 2.若该厂日产含铁1.4×10 4t的生铁,至少需要含Fe 2O 3 80%的赤铁矿的质量是多少?(要求写出计算过程)
一种新型"人造树叶"可吸收二氧化碳并转化为乙醇(C 2H 5OH)燃料,化学方程式为:2CO 2+3H 2O C 2H 5OH+3O 2.研究显示,一升"人造树叶"每天可从空气中吸收968g CO 2
(1)一升"人造树叶"工作一天可得到乙醇的质量是多少?
(2)若每天一棵树平均可吸收48.4g CO 2,则一升"人造树叶"吸收的CO 2相当于 棵树吸收的CO 2。
"人工固氮"每年能生产11.9亿吨氨(NH 3),反应原理为:N 2+3H 2 2NH 3
(1)根据化学方程式计算:"人工固氮"每年固定氮气的质量是多少?
(2)每年全球"雷电固氮"约能固定0.98亿吨氮气,"人工固氮"固定氮气的质量相当于"雷电固氮"的 倍。
实验室有一份在空气中潮解变质的氢氧化钠样品,质量为1.5g某实验小组将这份样品完全溶解,配成50g溶液,然后缓慢滴入7.3%的稀盐酸,同时进行搅拌,使二氧化碳全部逸出。滴加过程中,多次测得溶液pH和溶液总质量,部分数据如下表所示:
| 测量次数 |
第1次 |
第6次 |
第16次 |
第21次 |
第26次 |
| 滴加的盐酸总质量/g |
0 |
5 |
15 |
20 |
25 |
| 溶液总质量/g |
50 |
55 |
m |
69.78 |
74.78 |
| 溶液pH |
12.4 |
12.1 |
7.0 |
2.2 |
2.1 |
请分析计算:
(1)第 次测量时,溶液中只有一种溶质。
(2)表中m= 。
(3)样品中碳酸钠的质量分数。(计算结果精确到0.1%)
(4)1.5g样品中氢氧化钠固体的质量。
黄铜(铜锌合金)的外观与黄金极为相似,容易以假乱真。小红同学想测定黄铜中锌的含量。她称取20g黄铜样品放入烧杯中,加入足量稀硫酸充分反应后,测得生成氢气的质量为0.2g。
(1)该反应属于 (填基本反应类型)。
(2)求黄铜中锌的质量分数。(写计算过程)
[题干]在一支试管中放入一小段镁条(已擦去氧化膜),再向试管中加入一定量的盐酸,镁条表面有 产生,反应的化学方程式是 .
[发现问题]为了再次观察上述反应现象,小林同学用较长的镁条重做上述实验,但发现了异常现象,试管中出现了白色沉淀.
[实验验证1]小林同学针对两次实验的不同,设计对比实验方案,探究出现异常现象的原因.
| 试管(盛有同体积同浓度的盐酸) |
① |
② |
③ |
④ |
| 镁条长度 |
1cm |
2cm |
3cm |
4cm |
| 相同的实验现象(省略题干现象) |
快速反应,试管发热,镁条全部消失 |
|
|
|
| 沉淀量差异(恢复至20℃) |
无 |
少量 |
较多 |
很多 |
| |
|
|
|
|
[得出结论]镁条与盐酸反应产生白色沉淀与 有关.
[追问]白色沉淀是什么物质?
[查阅资料]①20℃时,100g水中最多能溶解氯化镁54.8g.
②镁能与热水反应产生一种碱和氢气;
③氯化银既不溶于水也不溶于稀硝酸.
[做出猜想]猜想一:镁;猜想二:氯化镁;猜想三:氢氧化镁,猜想的依据是 (用化学方程式表示).
[实验验证2]将白色沉淀洗涤干净,分别取少量沉淀于A、B、C试管中,进行如表实验:
| 试管 |
操作 |
现象 |
结论 |
| A |
加入足量盐酸 |
,白色沉淀 |
猜想一不正确,但这种白色沉淀能溶于盐酸 |
| B |
加入足量水 |
白色沉淀 |
猜想二不正确 |
| C |
加入适量稀硝酸 |
白色沉淀消失 |
原白色沉淀中含有的离子是: Mg 2+、 |
| 继续滴加几滴硝酸银溶液 |
出现大量白色沉淀 |
[拓展延伸]足量镁与盐酸反应过程中,溶液会经历从酸性到碱性并且碱性逐渐增强的过程,从而促使白色碱式氯化镁的生成.
以下是金属锡纯度的一种测定方法:
步骤i 将样品全部溶于盐酸生成SnCl 2溶液;
步骤ii 往所得SnCl 2溶液加入过量的FeCl 3溶液,发生反应:
SnCl 2+2FeCl 3═SnCl 4+2FeCl 2
步骤iii 用K 2Cr 2O 7溶液测定步骤ii反应生成FeCl 2的质量.
现有金属锡样品1.20g,经上述方法测得生成的FeCl 2质量为2.54g(假设杂质不参加反应),计算并回答:
(1)样品溶于盐酸生成的SnCl 2质量;
(2)样品中锡的质量分数(精确到0.01%)
“二氧化碳的实验室制取与性质”实验活动产生的废液中含稀盐酸,需先测定其溶质质量分数后进行处理。(杂质不参加反应)
(1)实验时需配制50g 5%的氢氧化钠溶液,若用氢氧化钠固体和水来配制。则需称量氢氧化钠固体的质量为 g。
(2)取20g废液样品于烧杯中,向其中逐滴加入5%的氢氧化钠溶液,恰好完全反应时共消耗氢氧化钠溶液16g。计算废液中盐酸的溶质质量分数。(写出计算过程)
(3)恰好完全反应时烧杯中的溶液所含粒子数目关系:Na+ Cl﹣. (填“>”、“=”或“<”)。
兴趣小组的同学在社会实践基地发现一袋商标模糊的硝酸铵化肥。同学们要帮助基地的工作人员测定化肥中硝酸铵的含量,请你参与他们的探究活动。
[查阅资料]1.铵态氮肥易溶于水。2.铵态氮肥与碱反应产生氨气。3.氨气易溶于水,溶液呈碱性。
[实验过程]小丽同学准确称取9.0 g硝酸铵化肥样品,与过量的氢氧化钙粉末混合,充分反应后,产生的氨气用足量的稀硫酸全部吸收,测得2分钟内稀硫酸溶液质量的变化,记录如下表所示(样品中的杂质不含氮元素,也不与氢氧化钙反应)。
时间/s |
0 |
20 |
40 |
60 |
80 |
100 |
120 |
溶液增加的质量/g |
0 |
0.7 |
1.2 |
1.5 |
1.6 |
1.7 |
1.7 |
[数据处理]
计算此化肥中硝酸铵的质量分数(写出计算过程)
[反思交流]
化肥对粮食增产有着重要的作用,如何科学合理使用或贮存铵态氮肥,请你给工作人员提一条合理化建议 。
试题篮
()