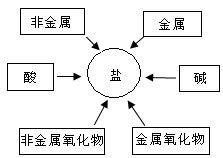
某同学对酸碱盐的知识进行了以下的梳理。
(1)填写下表空格中的化学式:
| 氯化钾 |
氯化钙 |
氯化钠 |
氯化镁 |
氯化铝 |
氯化锌 |
氯化亚铁 |
氯化铜 |
|
|
|
|
|
|
|
反思:根据以上盐中的金属元素的排列,可以得出是依据顺序归纳整理的。
(2)为理解稀盐酸和氢氧化钠两者之间发生反应的微观实质,绘制了下图。请你在右边的圆圈中填入适当的化学式或离子符号:

(3)此同学通过查阅资料,发现许多反应都有盐类物质生成(如图)。比如①用稀硫酸除铁锈;②古代记载的湿法冶金技术有"曾青得铁则化为铜",其中"曾青"是指硫酸铜溶液。请从①、②中任选一个,写出反应的化学方程式:。
化学来源于生活又服务于生活。下表是生活中常用物质溶液的pH及主要成分化学式:
请结合上表信息回答下列问题:
(1)当你被蚊虫叮咬(释放一种酸性物质)后,为减轻疼痛,可在叮咬处涂 (填序号);
(2)用久的铝壶内有水垢(主要成分为CaCO3),可用 (填序号)少量多次清除。
(9分)工业生产纯碱的工艺流程示意图如下: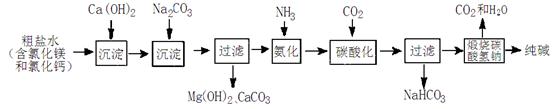
请完成下列填空:
(1)写出流程中一种氧化物的化学式 。
(2)NH3溶于水得到氨水,该溶液的pH 7(填写“大于”“小于”或“等于”)。
(3)写出下列反应的化学方程式:
①氯化镁溶液与氢氧化钙溶液反应 ;
②氯化钙溶液与碳酸钠溶液反应: 。
(4)工业生产纯碱的流程中,碳酸化时析出碳酸氢钠而没有析出碳酸钠的原因
是 。
(5)写出高温煅烧碳酸氢钠制取纯碱的化学方程式 。
实验室废液中含有硝酸银、硝酸铜,实验小组利用稀硝酸和铁粉分离回收银和铜,设计如下方案。
先在废液中加入过量的铁粉,充分反应后过滤得到滤渣
,其成分为银、铜和铁。再对滤渣
按如下流程图处理:

①先再废液中加入过量的铁粉,过量的目的是。
Ⅰ.加快反应速度 Ⅱ.铁的金属活动性较强 Ⅲ.使反应充分进行
②写出
与
反应的化学方程式。
③滤液
中溶质的成分有(填化学式)。
④含有硫酸亚铁的滤液有(填框图中字母)。
⑤如果在过滤操作中发现滤液浑浊,在仪器洁净、滤纸为破损的前提下,你认为滤液的浑浊的原因可能是。
早在春秋战国时期,我国就开始生产和使用铁器。
(1)写出用CO和赤铁矿(主要成分Fe2O3)为原料炼铁的化学方程式
,盛水的铁锅与水面接触的一圈最易生锈。钢铁生锈的条件是 ,利用新技术能将不锈钢加工成柔软的金属丝,这是利用了不锈钢的 (填字母)。
| A.耐腐蚀性 | B.延展性 | C.导热性 | D.导电性 |
(2)设计从废水中回收硫酸亚铁固体和铜的实验方案如下:
金属X是 ,
写出上述实验方案中有关反应的化学方程式
① ② 。
把某种金属用小刀轻轻切下一小块放入盛水的烧杯中,观察到该金属能与水剧烈反应,并放出热,本身熔化成银白色的小圆球,浮在水面上,根据以上叙述,推断该金属的物理性质有:①硬度________;②熔点________;③密度________;④颜色________。
孔雀石主要含Cu2(OH)2CO3〔也可认为是Cu(OH)2·CuCO3〕,还含少量Fe、Si的化合物。实验室以孔雀石为原料制备CuSO4·5H2O,步骤如下: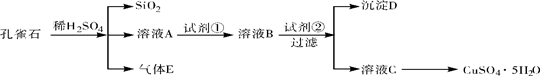
 请回答下列问题:(1)气体E的化学式是
请回答下列问题:(1)气体E的化学式是  。
。
(2)由溶液C获得CuSO4·5H2O,需要经过蒸发浓缩、冷却结晶、 和干燥等操作。
(3)写出孔雀石主要成分与稀硫酸反应的化学方程式: 。
正确看待和安全使用食品添加剂非常重要。下图是某超市售卖的2种不同品牌橙汁的标签。

①2种橙汁均属于 (填“纯净物”或“混合物”)
②你更倾向于选择的品牌是: (填“A”或“B”)为防范添加剂危害,选购包装食品时应 (至少一条)
某同学自制脱氧剂(2g铁粉、0.5g活性炭、0.5g食盐)进行如下实验: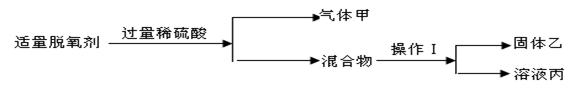
请回答①操作Ⅰ的名称是 ,乙在水的净化的作用是 ;溶液丙中含有的溶质是 (写化学式)
(5分)在学校的联欢晚会上,老师做了一个神奇的表演,向装有不同固体的试管中滴入适量不同的无色液体,产生了不同的现象。老师让同学们参与互动进行猜想:
(1)若固体为白色粉末,加液体后产生了能使澄清石灰水变浑浊的气体。则固体可能是(任写一种,下同) ,液体可能是 。
(2)若固体为白色,无气体产生,所得液体温度降低。则固体可能是 ,液体可能是 。
(3)若固体为黑色粉末,加液体后有气体产生,则黑色粉末可能是 。
高纯度硅(Si)是现代电子信息工业的关键材料,其制取原理如下图所示:
(1)原理中两次应用置换反应后,可以大大提高硅(Si)的纯度。置换反应在工业生产中具有重要的意义,通常置换反应可以用以下通式表示:单质+化合物 新单质+新化合物。根据已有知识及题目中的信息归纳完成表格:
新单质+新化合物。根据已有知识及题目中的信息归纳完成表格:
| |
单质类别 |
新单质类别 |
对应的置换反应的化学方程式(各举一例) |
| A |
金属 |
非金属 |
|
| B |
金属 |
另一种金属 |
|
| C |
非金属 |
金属 |
|
| D |
|
|
(2) 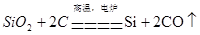 |
(2)原理图中反应②的基本反应类型为 。试写出③的化学反应方程式 。
石英的主要成分为二氧化硅,它是玻璃工业和陶瓷工业的原料,冶金工业的助熔剂。
(1)二氧化硅的结构与金刚石相似,都是由 (填“分子”、“原子”或“离子”)构成的,二氧化硅 (填“属于”或“不属于”)氧化物。
(2)装有氢氧化钠溶液的试剂瓶不能用玻璃塞,原因是在常温下,NaOH与玻璃塞中的SiO2缓慢地发生反应生成Na2SiO3和H2O,Na2SiO3使瓶口与瓶塞粘合在一起,则该反应的化学方程式为 。
(3)硅是太阳能电池和电脑芯片不可缺少的材料。生产高纯硅的流程示意图如下: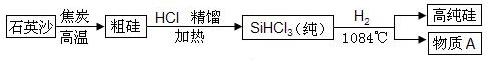
① 制备粗硅的反应为:SiO2 + 2C=== Si + 2CO↑。
② 整个制备过程必须达到无水无氧,若在H2还原SiHCl3过程中混入O2,可能引起的后果是 。
③ 为了达到绿色化学和节约资源的目的,物质A需要循环使用,A的化学式是 。
盐酸既是重要化工产品,又是生产硅材料的重要原料。 右图归纳出了盐酸与其它物质间相互反应的关系(图中“——”表示相连的两种物质能发生反应)。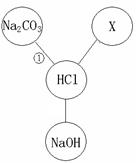
(1)若X是与其它三种不同类别的化合物,则X可以是(填化学式) 。(2)根据右图所示物质间关系,写出反应①的化学方程式:
;
现有一包固体粉末,可能由CaCO3、CaO、Na2CO3中的一种或几种组成。为确定其组成,进行了如下图所示的实验(假设实验过程无损耗)。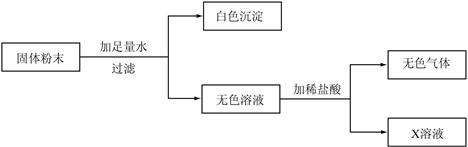
(1)根据实验可以确定白色沉淀是 ;原固体粉末中一定含有 ,它的可能组成有 种。
(2)若实验取固体粉末20g,生成白色沉淀10g,最后得到溶质质量分数为5.85%的X溶液200g(只含一种溶质),则X溶液中溶质的质量是 g,固体粉末由 (填化学式,下同)组成,其中质量小于10g的是 。
下图是对生成氯化钠反应关系的归纳与整理。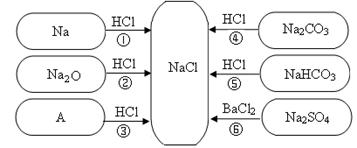
(1)物质A是常见的碱,写出A的化学式: 。
(2)写出反应①的化学方程式:_____________________________________。
(3)说出NaHCO3在医疗上的一种用途:____________________________________。
(4)反应③、④、⑤、⑥能够进行的原因是___________________________________________。
(5)实验室配制200g 8%的NaCl溶液,需要水的质量是___________g,配制过程中为了加快NaCl的溶解,可以采取的措施是_________________________________________。
试题篮
()