A.、B、C、D、E、F、G、H、I都是初中化学学过的物质.其中E、F、H均为黑色固体,B为紫红色固体,D为混合物.它们之间有下图转化关系(部分生成物已省去)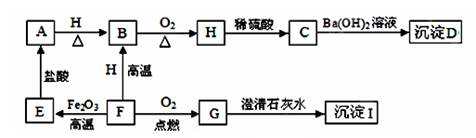
(1)指出B的一种用途 ,用化学式表示D的组成 、 .
(2)写出化学方程式:F→E H→C
G→I ,B→H .
(3)上述反应没有涉及到的基本反应类型是
有一种工业废水,含有大量的ZnSO4和少量CuSO4以及污泥。兴趣小组的同学想从中回收金属铜和硫酸锌晶体,他们设计了如下方案:
(1)操作a、b的名称是 ,其目的是除去溶液中 。步骤Ⅱ中发生反应的化学方程式为 。
(2)甲同学提出X可用金属铁,乙同学认为X可用金属锌,你认为 (填“甲”或“乙”)同学的意见是正确的,理由是 。步骤Ⅰ中加入过量的金属X的目的是 。
(3)若溶液1和溶液2中溶质ZnSO4的质量分数分别表示为a、b,则a、b的大小关系是__________;溶液3中的溶质是 (填化学式)。
氢化镁(MgH2)常被作为储氢介质,它与几种物质的转化关系如下。已知B、E之间发生中和反应,且F是一种盐酸盐。(所有的反应物和生成物均已标出)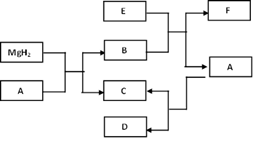
(1)写出E的化学式: ;
(2)在实验室发生A→C+D的反应条件是: ;
(3)C作为一种新能源具有很多优点,试写出其中的一个优点: ;
(4)写出MgH2 + A→B+C的化学方程式: 。
金属元素在生活、生产中,以及对人类的健康有着很重要的作用,请回答下列问题。
(1)金属加工后的废切削液中含有2~5%的NaNO2,它是一种环境污染物。人们用NH4Cl溶液来处理此废切削液,使NaNO2转化为无毒物质。该反应分两步进行:
第一步:NaNO2+NH4Cl=NH4NO2+X
第二步:NH4NO2=N2↑+2H2O
①第一步反应中X的化学式是 。
②NH4NO2中氮、氢、氧三种元素的质量比是 ,其中氮元素的化合价分别是 , 。
(2)如图是一盏废旧台灯,某实验小组的同学利用它进行观察分析并完成相关实验。
①小明发现台灯的铁螺丝钉表面已经锈蚀,原因是铁与空气中的 等发生了化学反应。
②小红发现铝箔反光片呈银白色,无锈迹,原因是铝表面有一层致密的氧化膜,生成该氧化膜的化学方程式为 。
③我国古代将炉甘石(ZnCO3)、赤铜(Cu2O)和木炭粉混合后加热到约800℃,得到一种外观似金子的合金,该合金的主要成分为 ,试写出有铜生成的化学方程式 。
(3)用金属铁制备自来水的新型消毒、净水剂K2FeO4的流程如下:请回答下列问题:
①固体B的成分是 ,反应a的化学方程式为: 。
②操作I的名称是 ;操作I所需要的仪器和用品:铁架台、玻璃仪器、试剂、 (填一种实验物品名称)。
③反应a、b、c中没有涉及到的化学反应类型是 (填字母代号)。
| A.化合反应 | B.分解反应 | C.置换反应 | D.复分解反应 |
(7分)以下是一些常见物质间互相转化的关系图(部分反应条件已省略)。已知A、B、X、Y均为无色气体,E、F为常见单质。
请回答:
(1)写出下列物质的化学式:F 、戊 。
(2)写出下列转化的化学方程式:
① 甲→A+B ;
② 乙+X→E+Y 。
(3)说出蓝色溶液丁中溶质的一种用途 。
A、B、C、D都是初中化学中常见物质,A是人类赖以生存的一种无色液体,D是一种黑色固体,具有如下图所示的转化关系(反应条件、其他反应物及多余产物均略去):
(1)写出①反应的化学方程式 ;
(2)D可能是 (填化学式);
某化学兴趣小组要对实验产生的废液进行研究。已知废液中可能含有硝酸钾、氯化铜、氯化钡、氢氧化钠中的一种或几种。请根据以下实验回答问题。
(1)首先,观察废液为无色,则废液中一定不含什么物质?
(2)然后,测试废液的pH为13,则废液中一是含有什么物质?
(3)接下来,向废液中加入过量的稀硫酸,产生白色沉淀,则废液中一定还含有什么物质?写出该反应的化学方程式。
某工厂废液中含有氯化钠、氯化铜和氯化亚铁。某课外小组利用废液制取海绵铜(Cu)和氧化铁两种产品,过程如下图所示(过程中不引入其他元素)。
请回答:
(1)试剂A是 ;固体B的成分是 ; 产品G是 。
(2)检验C过量的方法是 。
已知A是铜锈,主要成分是Cu2(OH)2CO3,物质转化关系如图所示.其中C、F、H、I是无色气体,B通电时,电源负极产生I,正极产生H.根据推断回答下列问题:
(1)铜生锈与空气中氧气、水和 (填化学式)有关。
(2)写出F和I的化学式:F: ;I: ;
(3)在①~⑥反应中属于化合反应的是 (填序号)。
(4)在实验室里加热一种固体可制备气体H,反应的化学方程式是 。
(5)反应①的化学方程式 。
铜制品久置在潮湿的空气中表面会有绿点出现,其主要成分铜绿 [Cu2(OH)2CO3] 受热分解生成三种氧化物。现有下图所示的转化关系
(部分生成物已略去)。
写出D物质的化学式 ;
C→ F的化学方程式为 ;
E和F反应的化学方程式为 。
写出E在农业生产中的一种用途
实验室有一包固体混合物,其中可能含有Cu(OH)2、CuO、NaOH、Fe、Na2CO3、CaCl2六种物质中的两种或多种。按下图所示进行实验,出现的现象如图中所述。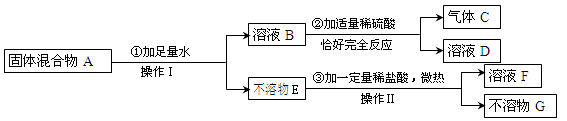
试根据实验过程和发生的现象判断:
(1)操作Ⅰ和操作Ⅱ的名称是 ,该操作用到的玻璃仪器有 、漏斗和烧杯。
(2)产生的气体C是 (写化学式,下同)。
(3)不溶物G显红色,则溶液F中一定含有的溶质是 。
(4)由以上可知:固体混合物A中,一定存在的物质是 ;写出过程③中肯定发生的化学反应方程式: (写一个即可)
构建知识网络是一种重要的学习方法,下面是某同学整理的关于碳酸钠化学性质的知识网络,能相互反应的物质之间用短线“﹣”表示,通过一步反应能直接转化的两种物质之前和箭号“→”表示(从反应物指向生成物).A、B属于不同类别的化合物.
请填写下列横线:
(1)该同学将A物质的溶液滴加到碳酸钠溶液中,观察到有无色气泡冒出,则A物质可能是 (填写一种物质的化学式).
(2)该同学归纳了,能够与碳酸钠溶液反应生成白色沉淀的B物质有多种,请选取其中一种,写出其与碳酸钠溶液反应的化学方程式 ;除你选取的物质所属类别外,B物质还可能属于 (填写物质类别).
(3)知识网络总是在不断的补充完善,该同学发现,有一种物质既能与碳酸钠发生双向转化,又能与硫酸钠发生双向转化,这种物质是 (填写化学式).
A、B、C、D、E是初中化学中常见的五种物质,它们都含有一种相同的元素,右图表示各物质之间的转化关系。其中,A为食盐的主要成分, B中含钡元素,D为有颜色溶液,E为蓝色溶液,其它物质的溶液都为无色;反应⑤和⑥为置换反应,其它均为复分解反应。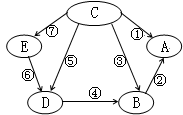
(1)写出物质C的化学式 。
(2)反应②的现象为 。
(3)反应⑥的化学方程式为 。
为了验证黄铜样品(Cu、Zn合金)中,铜的质量分数,小浩同学做了如下试验,往93.7g一定质量分数的稀硫酸溶液中,加入10g样品,并按时称量剩余固体的质量如下表:
| 反应时间(min) |
1 |
2 |
3 |
4 |
5 |
| 剩余固体质量 (g) |
6.75 |
5 |
4 |
3.5 |
3.5 |
(1)合金中铜的质量分数是 ;
(2)反应后溶液中溶质质量分数是多少?
(3)往溶液中加入合金样品时,剩余固体的质量为什么开始减少较快,而后逐渐减少较慢。
如图所示A为黑色固体,D是红色的金属单质,C是一种蓝色沉淀,B为硫酸盐,E、F为硝酸盐,且F的溶液呈蓝色。各物质间的转化均一步实现。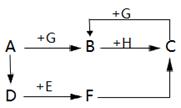
(1)写出物质C、B、G的化学式:C ,B ,G 。
(2)写出A→B的化学反应方程式: 。
(3)B→C属于 反应(填基本反应类型)。
试题篮
()