将25g石灰石样品(杂质不溶于水,也不参加反应)跟188.8g的盐酸溶液充分
完全反应后,烧杯中物质的总质量为205g。试计算:
(1)反应产生的二氧化碳的质量是 g。
(2)反应所得溶液的溶质质量分数。
在做电解水实验时,常在水中加入氢氧化钠来增强溶液的导电性,但氢氧化钠本身不会发生化学反应,质量也不会发生改变。现将含有8g氢氧化钠的水溶液109g通电一段时间后,生成1g氢气,请你计算(要有计算过程):
(1)电解所消耗的水的质量;
(2)电解水后的氢氧化钠溶液的质量分数。
实验室中有一瓶存放时间过长的
药品,其中一部分已转化为
。取lOg该药品放入烧杯中,加154g水配成溶液,将400g一定溶质质量分数的
溶液分四次加人该烧杯中,充分反应后,测得生成沉淀质量的数据记录如下表:

(1)m=,
(2)求10g该药品中
的质量,
(3)第三次加入
溶液充分反应后,所得溶液中溶质质量分数是多少?
一定量的溶液中含有 和 两种溶质,向其中加人lO0 溶质质量分数为37℅的稀 .恰好完全反应且溶液呈中性,将反应后的溶液蒸干.所得固体的质量是
| A. | 7.45 | B. | 14.9 | C. | 5. 6 | D. | 13 8 |
小雨从超市买同一包纯碱,其包装说明如图1所示。他称取了11g纯碱样品溶于
水中配制成50g溶液,然后向溶液中滴加氯化钙溶液,其产生沉淀的质量与滴加氯化钙溶液
的质量关系如图2所示。

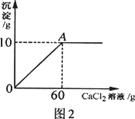
(1)通过计算判断纯碱样品中碳酸钠的质量分数是否与包装说明相符。
(2)计算A点时,所用溶液中溶质的质量分数。(计算结果保留一位小数)
钠与水反应生成
和
,现向95.6克水中加入4.6克钠,充分反应(有
水剩余)。求:(1)生成
的质量是多少?
(2)反应后溶液中溶质的质量分数是多少?
将20克甲、5克乙、8克丙三种纯净物混合,在密闭容器中加热发生化学反应,经分析可知:反应后混合物中含有5克甲、16克丙,还含有一种新物质丁。则丁物质的质
量是
| A. | 12 | B. | 9 | C. | 4 | D. | 17 |
酸和碱作用生成盐和水的反应叫做中和反应。已知甲、乙分别是盐酸和氢氧化钠溶液中的一种,如图表示向
克溶质质量分数为
的乙溶液中加入甲时溶液
的变化曲线。请完成下列问题:

(1)甲是(填名称) ;
(2)要求
点溶液中溶质的质量分数,若知道加入甲溶液的或的数据即可。
(3)若用
表示加入甲溶液的某一数据,试计算
点溶液中溶质的质量分数 。(任选一个数据计算即可)
已知可溶性盐在水溶液中能解离出金属离子和酸根离子。某溶液中含有 、 、 、 四种离子,其中 、 、 的个数比为 ,则可推断出溶液中 、 、 的个数比为
| A. | B. | C. | D. |
氯化镁是制取镁的原料之一。现要测定某化工产品(含MgCl2和KCl)中所含的氯化镁质量分数,进行实验:先将10g样品完全溶于水,然后把50g一定质量分数的氢氧化钾溶液平均分五次加入样品溶液中,充分振荡,实验所得数据见下表:

请分析上述数据,回答下列问题:
(1)表中a为。
(2)样品中的氯化钾属于化肥中的肥,可回收利用。
(3)所用的氢氧化钾溶液中溶质的质量分数是。
(4)计算样品中氯化镁的质量分数是多少?(写出计算过程)
(11分)某合金可能由铜与镁、锌中的一种组成,现欲测定其组成,进行如下实验:取该合金样品10.0 g放入烧杯中,然后将56.0 g溶质质量分数为14.0%的稀硫酸平均分四次依次加入该烧杯中,每次均充分反应。实验数据记录如下表:
试求:
(1)该合金中铜的质量分数是__________。
(2)该合金除了铜外,另一种金属的是什么呢?(写出过程)
(3)第三次加入硫酸充分反应后,所得溶液中溶质的质量分数是多少?(写出计算过程,结果精确到0.1%)
(5分)某化学兴趣小组欲测定某石灰石样品中碳酸钙的质量分数。取20 g石灰石样品(假设杂质既不溶于水,也不与其他物质反应),向其中加入100 g一定溶质质量分数的稀盐酸,恰好完全反应,称得固液混合物的质量为113.4 g。请回答下列问题:
(1)写出发生反应的化学方程式________________________________________;
(2)列出求解该样品中参加反应的碳酸钙质量(x)的比例式________________;
(3)该样品中碳酸钙的质量分数为________;
(4)向反应后的固液混合物中加入113.6 g水,充分搅拌后过滤,得到只含一种溶质的不饱和溶液,则所得不饱和溶液中溶质的质量分数为_____;
(5)欲配制150 g上述实验所用的稀盐酸,需要36.5%的浓盐酸质量为_______________---。
图l表示向一定量氯化钙和稀盐酸的混合溶液中滴加碳酸钠溶液,横坐标表示加入的碳酸钠溶液的质量,纵坐标表示实验中得到的沉淀或气体的质量;图2表示一定体积的气体X和不同体积的氧气反应(若反应生成水,水为液态),横坐标表示通入的氧气体积;纵坐标表示反应后气体的总体积(反应前、后的温度与压强相同.同温同压下,相同体积的任何气体含有相同的分子数)。
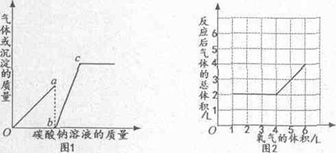
下列叙述中正确的是()
①图l中oa段表示实验中沉淀质置的变化情况
②图l中c点表示上述混合溶液与碳破钠溶液恰好完全反应
③由图2可知,反应前X的体积为2L
④由图2可知,x可能是
或
A.①④ B. ②③ C.①②④ D. ②③④
已知氧气的密度为1.43g/L,空气的密度为1.29g/L,一般情况下,正常成年人每分钟吸入8L氧气。问正常成年人每分钟需要吸入空气多少升?在标准状况下,8L氧气的质量是多少克?所需要空气的质量为多少克?
某炼铁厂在高温条件下利用一氧化碳还原赤铁矿(主要成分是
)。现有100t的赤铁矿,理论上可炼得纯铁56t。(反应的化学方程式:
)
计算:
(1)
中碳元素和氧元素的质量比;
(2)求赤铁矿中
的质量分数。
试题篮
()