下列物质中,中心原子的杂化类型为sp3杂化的是
| A.BeCl2 | B.NH3 | C.BF3 | D.C2H4 |
(物质结构与性质)有A、B、C、D、E、F 6种元素,B原子得到一个电子后3p轨道全充满,A+比B形成的简单离子少一个电子层;C原子的p轨道半充满,形成的氢化物的沸点是同主族元素的氢化物中最低的;D和E是位于同一主族的短周期元素,E元素的最高化合价和最低化合价的代数和为零,E在其最高价氧化物中的质量分数为46.67%;F元素的核电荷数为26。请回答下列问题:
(1)A元素位于元素周期表中第_________周期第__________族;;F元素基态原子形成的+3价阳离子的电子排布式为___________。
(2)C与B形成的CB3分子中C原子的杂化方式是____________,其分子的空间构型是____________
(3)另一元素X与A同主族,第一电离能小于A,晶体XB与AB中熔点较高的是 _____________,其理由是______________________
(4)1mol ED晶体中含有的E—D键的数目是____________。
下列有关晶体的说法正确的是
| A.分子晶体中一定不含离子键 | B.分子晶体中一定含有共价键 |
| C.离子晶体中一定只含离子键 | D.离子晶体的熔点一定比共价化合物高 |
(6分)、下列五种物质中,①Ar ②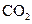 ③
③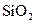 ④NaOH ⑤
④NaOH ⑤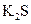 ,只存在共价键的是 ,只存在离子键的是 ,既存在离子键又存在共价键的是 ,不存在化学键的是 。属于共价化合物的是 属于离子化合物的是 。(填序号)
,只存在共价键的是 ,只存在离子键的是 ,既存在离子键又存在共价键的是 ,不存在化学键的是 。属于共价化合物的是 属于离子化合物的是 。(填序号)
(12分)阅读以下信息,并回答问题
数十亿年来,地球上的物质不断地变化。大气的成分也发生了很大的变化。下表是原始大气和目前空气的主要成分:
用上表所涉及的分子填写下列空白:
(1)由极性键构成的非极性分子有________和__________(填写化学式)。
(2)极易溶于水、其水溶液呈碱性的物质的分子是_________(填写化学式),它之所以极易溶于水,是因为它的分子和水分子之间可形成_______键。
(3)分子中不含孤对电子的分子(除稀有气体外)为__________(填写化学式),它的立体构型为____________。
(4)CO的结构可表示为 ,与CO结构最相似的分子是________(填写化学式),这两种结构相似的分子中,分子的极性________(填“相同”或“不相同”),CO分子中有一个键的形成与另外两个不同,它叫________键。
,与CO结构最相似的分子是________(填写化学式),这两种结构相似的分子中,分子的极性________(填“相同”或“不相同”),CO分子中有一个键的形成与另外两个不同,它叫________键。
(5)随着原始大气中O2的缓慢增加,CH4、NH3、CO等气体逐渐被氧气氧化而缓慢地减少,使大气的成分逐渐演化成目前空气。原始大气中NH3可转化为目前空气中的__________(填化学式)。下
(6)人工模拟是当前研究的热点。有研究表明,化合物X可用于研究模拟酶,当其结合或Cu(I)(I表示化合价为+1)时,分别形成a和b:下
分析a和b中微粒间的相互作用(包括化学键和分子间相互作用),试指出其不同点:
a中含 ,b中含 。(用“氢键”、“配位键”、“极性键”、“非极性键”等填空)
A、B、C、D四种短周期元素原子序数依次增大,A元素原子的价电子排列为ns2np2,B元素的最外层电子数是其电子层数的3倍,E元素原子的价电子排布为3d64s2。C、D的电离能数据如下(kJ·mol―1):
| |
I1 |
I2 |
I3 |
I4 |
| C |
738 |
1451 |
7733 |
10540 |
| D |
577 |
1817 |
2745 |
11578 |
(1)化合价是元素的一种性质。由C、D的电离能数据判断,C通常显 价,D显 价;
(2)某单质甲分子与化合物AB分子中电子总数相等,则甲分子中包含___个σ键,___个π键;
(3)AB的总键能大于甲的总键能,但AB比甲容易参加化学反应。根据下表数据,说明AB比甲活泼的原因是______________________________
| |
单键 |
双键 |
叁键 |
|
| AB |
键能(kJ·mol―1) |
357.7 |
798.9 |
1071.9 |
| 甲 |
键能(kJ·mol―1) |
154.8 |
418.4 |
941.7 |
(4)E能与AB形成配合物,其中E提供______________,AB提供________________。
(5)下列晶胞中,阳离子与阴离子的个数为 
下列五种物质中,①H2O ②CO2③Na2O2 ④NaOH ⑤NaBr,只存在共价键的是__________,只存在离子键的是__________,既存在离子键又存在共价键的是_________,含有极性键的是__________,是非极性分子的是________。(填编号)下
(2分)已知元素电负性的差值大于1.7时,原子间形成离子键,小于1.7时,原子间形成共价键,请指出下列原子之间形成的化学键是离子键还是共价键。
Be(1.5)和F(4.0):____________,Si(1.8)和Cl(3.0):____________。
下列含有非极性键的离子晶体是 ( )
①醋酸钠固体 ②氢氧化钾固体 ③过氧化钠固体
④金刚石 ⑤固态乙醇 ⑥氯化钙固体
| A.③⑥ | B.①③ | C.③④⑤ | D.②⑥ |
以共价单键相连的非金属单质中,1个原子与相邻原子成键的数目为(8-N)个,N为该非金属元素的族序数,这一现象被化学家称为8-N规则。某非金属单质的结构如图所示,构成该单质的元素位于( )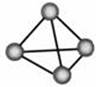
| A.第ⅢA族 | B.第ⅣA族 |
| C.第ⅤA族 | D.第ⅥA族 |
现有如下各种说法,正确的是 ( )
①在水中氢、氧原子间均以化学键相结合
②分子中键能越大,键长越长,则分子越稳定
③干冰受热变为气体和碘升华所克服的粒子间作用力属于同种类型
④H2S和CS2分子都是含有极性键的极性分子
⑤乙烯分子中C-C之间未参加杂化的2p轨道形成π键
⑥CH4、NH3、CCl4分子的空间构型是正四面体形
| A.①③⑤ | B.②⑥ | C.③⑤ | D.③④⑤ |
共价键、离子键、金属键、范德华力和氢键都是微观粒子之间的不同作用力,下列物质:①Na2O2;②冰;③金刚石;④碘单质;⑤CaCl2;⑥白磷,其中只含有两种作用力的组合是 ( )
| A.①④⑥ | B.①③⑥ | C.②④⑥ | D.①②③⑥ |
试题篮
()