明矾石经处理后得到明矾【】。从明矾制备
、
和
的工艺过程如下所示:

焙烧明矾的化学方程式为:
请回答下列问题:
(1)在焙烧明矾的反应中,还原剂是。
(2)从水浸后的滤液中得到晶体的方法是。

(3)在一定条件下可制得
,其晶体结构如右图所示,该晶体中
的配位数是。
(4)以和
为电极,
溶液为电解液组成一种新型电池,放电时
转化为
,该电池反应的化学方程式是。
(5)焙烧产生的可用于制硫酸。已知25℃、101
时:
;
;
。
则与
反应的热化学方程式是。
焙烧948明矾(
),若
的利用率为96%,可生产质量分数为98%的硫酸
。
丙酸的结构为CH3—CH2—COOH,丙酸盐是安全有效的防霉、防腐剂,一种以碱式碳酸锌为原料的生产工艺流程如下:
| 序号 |
n(丙酸)∶ n(碱式碳酸锌) |
反应温度/℃ |
丙酸锌产率/% |
| 1 |
1∶0.25 |
60 |
67.2 |
| 2 |
1∶0.25 |
80 |
83.5 |
| 3 |
1∶0.25 |
100 |
81.4 |
| 4 |
1∶0.31 |
60 |
89.2 |
| 5 |
1∶0.31 |
80 |
90.1 |
| 6 |
1∶0.31 |
100 |
88.8 |
(1)探究本实验中最佳工艺条件(见上表):反应时间2 h,用水量45 g,n(丙酸)∶n(碱式碳酸锌)=1∶ ,反应温度 ℃。
,反应温度 ℃。
(2)本工艺采用“闭路循环”方式,除具有制备工艺简便、产率高外,还具有 的优点。
(3)某次实验时,将37.0 g丙酸溶于220 mL水中,按上述流程在上述优化的条件下制备,最终得丙酸锌49.6 g,则该次实验丙酸锌的产率为 (写出计算过程)。
某工厂用CaSO4、NH3、H2O、CO2制备(NH4)2SO4,其工艺流程如下: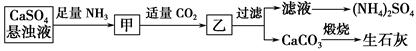
下列推断不合理的是 ( )。
| A.生成1 mol(NH4)2SO4至少消耗2 mol NH3 |
| B.CO2可被循环使用 |
| C.往甲中通CO2有利于(NH4)2SO4的生成 |
| D.直接蒸干滤液即可得到纯净的(NH4)2SO4 |
高铁酸钾(K2FeO4)是一种集氧化、吸附、絮凝于一体的新型多功能水处理剂,其生产工艺如下: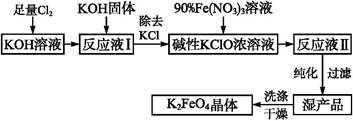
已知:①2KOH+Cl2 KCl+KClO+H2O(条件:温度较低)
KCl+KClO+H2O(条件:温度较低)
②6KOH+3Cl2 5KCl+KClO3+3H2O(条件:温度较高)
5KCl+KClO3+3H2O(条件:温度较高)
③2Fe(NO3)3+3KClO+10KOH 2K2FeO4+6KNO3+3KCl+5H2O
2K2FeO4+6KNO3+3KCl+5H2O
回答下列问题:
(1)该生产工艺应在 (填“温度较高”或“温度较低”)的情况下进行。
(2)写出工业上制取Cl2的化学方程式 。
(3)K2FeO4可作为新型多功能水处理剂的原因 。
(4)配制KOH溶液时,是在每100 mL水中溶解61.6 g KOH固体(该溶液的密度为1.47 g·mL-1),它的物质的量浓度为
(5)在“反应液Ⅰ”中加入KOH固体的目的是:① ;② 。
;② 。
(6)从“反应液Ⅱ”中分离出K2FeO4后,副产品是 (写化学式)。
[化学选修——2:化学与技术](15分)往有机聚合物中添加阻燃剂,可增加聚合物的使用安全性,扩大其应用范围。例如,在某聚乙烯树脂中加入等质量由特殊工艺制各的阻燃型Mg(OH)2,树脂可燃性大大降低。该Mg(OH)2的生产工艺如下:
(1)精制卤水中的MgCl2与适量石灰乳反应合成碱式氯化镁[Mg(OH)2-xClx·mH2O],反应的化学方程式为___________
(2)合成反应后,继续在393 K~523 K下水热处理8 h,发生反应; [Mg(OH)2-xClx·mH2O]= 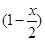 Mg(OH)2+
Mg(OH)2+ 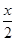 MgCl2+mH2O水热处理后,过滤、水洗。水洗的目的是___________。
MgCl2+mH2O水热处理后,过滤、水洗。水洗的目的是___________。
(3)阻燃型Mg(OH)2具有晶粒大,易分散、与高分子材料相容性好等特点。上述工艺流程中与此有关的步骤是______________。
(4)已知热化学方程式:
Mg(OH)2(s)=MgO(s)+H2O(g) △H1="+81.5" kJ·mol﹣1
Al(OH)3(s)===XAl2O3(s)+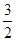 H2O(g) △H2="+87.7" kJ·mol﹣1
H2O(g) △H2="+87.7" kJ·mol﹣1
①Mg(OH)2和Al(OH)3起阻燃作用的主要原因是_______________
②等质量Mg(OH)2和Al(OH)3相比,阻燃效果较好的是_________。
原因是___________________。
(5)常用阻燃荆主要有三类:A.卤系,如四溴乙烷;B.磷系,如磷酸三苯酯;C.无机类Mg(OH)2和Al(OH)3。从环保的角度考虑,应用时较理想的阻燃剂是________,理由是________________
(15分)我国是氧化铝生产大国,工业上每生产1 t氧化铝将排出1~2 t赤泥,赤泥大量堆积会对环境造成严重污染。赤泥中主要成分及含量:CaO约占46%、SiO2约占22%、Al2O3约占7%、Fe2O3约占11%、TiO2约占5%及少量其他物质。
⑴一种利用废弃赤泥的方法是将赤泥配成一定的液固比,作为一种吸收剂,吸收热电厂排放的含SO2的烟气,写出吸收SO2时可能发生的化学反应方程式______________________。
⑵为综合利用赤泥中的各种成分,某科研小组设计了如下工艺流程: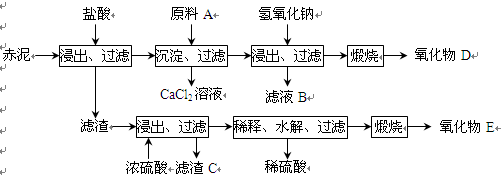
已知:TiO2不溶于稀盐酸、稀硫酸,能溶于浓硫酸生成TiOSO4(硫酸氧钛,易水解)。
①氧化物D的化学式是_____________,原料A最好是下列物质中的____________。
| A.氨水 | B.氢氧化钠 | C.生石灰 | D.双氧水 |
②写出上述工艺中投入氢氧化钠时反应的离子方程式:
______________________________________________________。
③写出上述工艺中稀释时发生水解反应的化学方程式:
______________________________________________________。
化工生产需要用到各种原料,其中与事实相符合的是
| A.用乙醇和浓硫酸制乙烯 | B.用电解水获得的氢气来合成氨 |
| C.用晒盐后的卤水制溴单质 | D.用氢氧化钠和二氧化碳制碳酸钠 |
废旧硬质合金刀具中含碳化钨()、金属钴(
)及少量杂质铁,利用电解法可回收
和
。工艺流程简图如下:

(1)电解时废旧刀具做阳极,不锈钢做阴极,溶液为电解液。阴极主要的电极反应式为。
(2)净化步骤所得滤饼的主要成分是。回收的洗涤液代替水配制电解液,目的是回收利用其中的。
(3)溶液I的主要成分是。洗涤不充分对最终产品纯度并无明显影响,但焙烧时会造成环境污染,原因是。
(4)将还原成
粉的化学反应方程式为。
(1)某工厂每天要烧掉含硫1.6%的烟煤200 t,排放出的SO2会严重污染环境,如果变废为宝,将这些SO2回收利用,那么理论上每年(按365 d计)可生产98%的浓硫酸 吨;
(2)若要在铁制件表面镀镍,则镍应与电源的 极相连,电镀液可以用硫酸镍溶液,电镀过程中硫酸镍溶液的浓度会 (填“增大”“减小”或“不变”);
(3)工业上制造水泥、玻璃时都要用到的原料是 (填编号),用所选原料制玻璃的化学方程式是 ;
| A.纯碱 | B.熟石灰 | C.石灰石 | D.黏土 |
(4)炼铁和炼钢过程的主要区别是 ;
(5)明矾净化水的原理是
(用离子方程式表示);具有暂时硬度的水中除去Mg2+的方法是 、
(用化学方程式表示)。
下列叙述正确的是
| A.金属被人类开发利用的大致年限之所以有先后,主要取决于金属在地壳中的含量多少 |
| B.海水中含有丰富的碘元素,因此碘被称为“海洋元素” |
| C.高炉炼铁的主要反应原理是碳在高温下直接将氧化铁还原成铁 |
| D.在海水中加入石灰乳可得氢氧化镁沉淀,这是从海水中富集镁的基本方法 |
化学选修:化学与技术分
鄂尔多斯市已探明煤炭储量1496亿多吨,约占全国总储量的1/6。煤是重要的能源,也是生产化工产品的重要原料。试用所学知识,解答下列问题。
(1)煤的转化技术包括煤的气化技术和液化技术。煤的液化技术又分为________和________________。
(2)在煤燃烧前需对煤进行脱硫处理。煤的某种脱硫技术的原理为
FeS2 Fe2++SO42-
Fe2++SO42- Fe3+
Fe3+
这种脱硫技术称为微生物脱硫技术。该技术的第一步反应的离子方程式为________________,第二步反应的离子方程式为_________________________________________________。
(3)工业煤干馏得到的产品有焦炭、_____________________________________。
(4)工业上主要采用氨氧化法生产硝酸,如图是氨氧化率与氨-空气混合气中氧氨比的关系。其中直线表示反应的理论值;曲线表示生产实际情况。当氨氧化率达到100%,理论上r[n(O2)/n(NH3)]=___________,实际生产要将r值维持在1.7~2.2之间,原因是__________________________________________。
活性ZnO俗称锌白,能改进玻璃的化学稳定性,可用于生产特种玻璃。工业上由粗锌ZnO(含FeO、CuO等)制备ZnO,采取酸浸入、净化除杂、中和沉淀、干燥等步骤,工艺如下:

(1)该流程中物质X可以是下列中的 ( )
| A.ZnO | B.NaOH | C.Zn(OH)2 | D.Na2CO3 |
(2)已知ZnO为两性氧化物,与氢氧化钠溶液反应可生成可溶性的锌酸盐(ZnO22-),写出反应的离子方程式 ;
(3)写出加入H2O2时发生反应的离子方程式 ;
(4)加入Zn后,过滤所得的滤渣有 ;
(5)上述流程中多次用到了过滤操作,请写出过滤时用到的玻璃仪器: ;
(6)检验滤液A中溶质的阴离子的方法是 。
(7)取碱式碳酸锌水合物6.82g,溶于盐酸中生成二氧化碳448mL(标况下),溶解过程消耗氯化氢0.12摩尔,若该碱式盐中氢元素的质量分数为1.76%,试推测该碱是碳酸锌水合物的化学式是 。
(15分)氯化亚铜(CuCl)是有机合成工业中应用较广泛的催化剂,它是白色粉末,微溶于水,不溶于乙醇,在空气中会被迅速氧化。从酸性电镀废液(主要含Cu2+、Fe3+)中制备氯化亚铜的工艺流程图如下:
请回答下列问题:
(1)电镀污泥的主要成分是 (写化学式);
(2)酸浸时发生反应的离子方程式是 ;
(3)析出CuCl晶体时的最佳pH在 左右;
(4)铁粉、氯化钠、硫酸铜在溶液中反应生成CuCl的离子反应方程式为:
;
(5)析出的CuCl晶体要立即用无水乙醇洗涤,然后真空干燥、冷却,密封包装。真空干燥,密封包装的目的是 。
上利用硫铁矿烧渣(主要成分为Fe2O3、FeO、SiO2等)为原料制备高档颜料铁红(Fe2O3),具体生产流程如下:
试回答下列问题:
(1)滤液X中含有的金属阳离子是______________(填离子符号)。
(2)步骤Ⅲ中可选用________调节溶液的pH(填字母)。
| A.稀硫酸 | B.氨水 | C.氢氧化钠溶液 | D.高锰酸钾溶液 |
(3)步骤Ⅳ中,FeCO3沉淀完全后,溶液中含有少量Fe2+,检验Fe2+的方法是________________________________。
(4)步骤Ⅳ的反应温度一般需控制在35℃以下,其目的是_____________________________________________。
(5)在空气中煅烧FeCO3生成产品氧化铁的化学方程式为______________________________。
试题篮
()