某稀溶液中含有Fe(NO3)3.Cu(NO3)2.HNO3,向其中逐渐加入铁粉,溶液中Fe2+的浓度(纵坐标)和加入铁粉的物质的量(横坐标)之间的关系入右图所示,则溶液中Fe(NO3)3、Cu(NO3)2、HNO3物质的量浓度之比为( )
| A.1:1:1 | B.1:3:1 | C.3:3:8 | D.1:1:4 |
含有a mol FeBr2的溶液中,通入x mol Cl2。下列各项为通Cl2过程中,溶液内发生反应的离子方程式,其中不正确的是( )
| A.x=0.4a,2Fe2++Cl2=2Fe3++2Cl- |
| B.x=0.6a,2Br-+ Cl2=Br2+2Cl- |
| C.x=a,2Fe2++2Br-+2Cl2=Br2+2Fe3++4Cl- |
| D.x=1.5a,2Fe2++4Br-+3Cl2=2Br2+2Fe3++6Cl- |
化学方程式可简明地体现元素及其化合物的性质。已知:
氧化还原反应:2FeCl3 + 2HI = 2FeCl2 + I2 + 2HCl; 2Co(OH)3 + 6HCl = 2CoCl2 + Cl2↑ + 6H2O
2Fe(OH)2 + I2 + 2KOH= 2Fe(OH)3 + 2KI; 3I2 + 6KOH=" 5KI" + KIO3 + 3H2O
复分解反应:
2HSCN + K2CO3 =" 2KSCN" + CO2 ↑ + H2O; KCN + CO2 + H2O =" HCN" + KHCO3
热分解反应:
4NaClO  3NaCl + NaClO4;NaClO4
3NaCl + NaClO4;NaClO4 NaCl + 2O2↑
NaCl + 2O2↑
下列说法不正确是:
| A.热稳定性:NaCl > NaClO4 > NaClO |
| B.还原性(碱性溶液):Fe(OH)2 > I2 > KIO3 |
| C.氧化性(酸性溶液):FeCl3 > Co(OH)3> I2 |
| D.酸性(水溶液):HSCN > H2CO3 > HCN |
已知,Fe2+结合S2—的能力大于结合OH—的能力,而Al3+则正好相反,I2的氧化性比S强。在Fe2(SO4)3和AlCl3的混合溶液中,先加入过量的KI溶液,再加入足量的Na2S溶液,所得沉淀是( )
| A.FeS、Al(OH)3和S | B.Fe(OH)3和Al(OH)3 |
| C.Fe2S3和 Al(OH)3 | D.Al2S3、FeS和S |
有一混合溶液,其中只含有Fe2+、Cl﹣、Br﹣、I﹣(忽略水的电离),Cl﹣、Br﹣、I﹣的个数比为2:3:4,向该溶液中通入氯气使溶液中Cl﹣和Br﹣的个数比为3:1,则通入氯气的物质的量与溶液中剩余Fe2+的物质的量之比为( )
| A.7:4 | B.7:3 |
| C.7:2 | D.7:1 |
Cl2是纺织工业常用的漂白剂,Na2S2O3可作为漂白布匹后的“脱氯剂”.S2O32﹣和Cl2反应的产物之一为SO42﹣.下列说法不正确的是( )
| A.该反应中还原剂是S2O32﹣ |
| B.H2O参与该反应,且作氧化剂 |
| C.根据该反应可判断氧化性:Cl2>SO42﹣ |
| D.上述反应中,每生成l mol SO42﹣,可脱去2mol Cl2 |
下列判断中一定正确的是
| A.若A2+2D-===2A-+D2,则还原性:D->A- |
| B.若R2+和M+的电子层结构相同,则碱性:ROH>MOH |
| C.若X2、Y2都是气态单质,且酸性HX>HY,元素原子得电子能力X>Y |
| D.若M、N是同主族元素,且原子序数:M>N,则元素原子得电子能力:M>N |
已知反应:①2BrO3- + Cl2 =Br2 +2ClO3- ②ClO3- +5Cl-+6H+=3Cl2 +3H2O
下列粒子氧化能力强弱顺序正确的是
| A.ClO3->BrO3->Cl2 | B.BrO3- >Cl2>C1O3- |
| C.Cl2>BrO3->C1O3- | D.BrO3->ClO3->Cl2 |
在氯化铁、氯化铜和盐酸的混合溶液中加入铁粉,待反应结束所剩余的固体滤出后能被磁铁吸引,则反应后溶液中存在的较多的阳离子是
| A.Cu2+ | B.Fe3+ | C.Fe2+ | D.H+ |
已知浓H2SO4和Fe3+都可以将Cu氧化(Fe3+与Cu的反应为:2Fe3+ + Cu = 2Fe2+ + Cu2+),浓H2SO4还可以将Br-氧化成Br2,Fe与Br2反应生成FeBr3,则有关物质氧化性强弱的顺序为
| A.H2SO4(浓) > Cu2+ > Fe3+ > Br2 | B.H2SO4(浓) > Br2 > Fe3+ > Cu2+ |
| C.Br2 > H2SO4(浓) > Cu2+ > Fe3+ | D.Cu2+ > Fe3+ > Br2 > H2SO4(浓) |
二氯化二硫(S2Cl2)是广泛用于橡胶工业的硫化剂,其分子结构如下图所示。常温下,S2Cl2遇水易水解,并产生能使品红褪色的气体。下列说法错误的是( )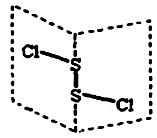
A.S2Cl2与H2O反应的化学方程式可能为: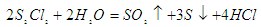 |
| B.S2Cl2为含有极性键和非极性键的极性分子 |
| C.S2Br2与S2Cl2结构相似,熔沸点:S2Br2> S2Cl2 |
D.S2Cl2的电子式是: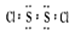 |
在稀硫酸中加入铜粉,铜粉不溶,再加入下列固体粉末:①FeCl2; ②Fe2O3;③Zn;④KNO3; ⑤HCl; 铜粉可溶解的是 ( )
| A.①②⑤ | B.②④ | C.②③⑤ | D.只有④ |
试题篮
()