在室温下,发生下列几种反应:
①16H++10Z-+2XO4-=2X2++5Z2+8H2O ②2A2++B2=2A3++2B- ③2B-+Z2===B2+2Z一
根据上述反应,判断下列结论错误的是
| A.溶液中可发生:Z2+2A2+=2A3++2Z- |
| B.Z2在①、③反应中作还原剂 |
| C.氧化性强弱的顺序为:XO4->Z2>B2>A3+ |
| D.生成2mol X2+,Z-失去电子10 mol |
把SO2通入Fe(NO3)3溶液中,溶液由棕黄色变为浅绿色,但立即又变为棕黄色,这时若滴入BaCl2溶液,会产生白色沉淀。在上述一系列变化过程中,最终被还原的是
| A.SO2 | B.C1- | C.Fe3+ | D.NO3- |
工业上制取ClO2的化学反应:2NaClO3+SO2+H2SO4=2ClO2+2NaHSO4,下列说法中正确的是
| A.NaClO3在反应中失去电子 | B.SO2在反应中被氧化 |
| C.H2SO4在反应中作氧化剂 | D.1 mol氧化剂在反应中得到2 mol电子 |
Na2O2、CaC2都能与水反应,且反应中都有气体放出。下列说法正确的是
| A.都属于氧化还原反应 | B.生成的气体均为氧化产物 |
| C.反应物水均作氧化剂 | D.反应均放热 |
根据下列化学方程式:2KMnO4+16HCl=2KCl+2MnCl2+5Cl2↑+8H2O、2FeCl2+Cl2=2FeCl3、2FeCl3+2KI=2FeCl2+2KCl+I2,判断各物质氧化性由大到小的顺序正确的是
| A.I2>Cl2>FeCl3>KMnO4 | B.KMnO4 >Cl2>FeCl3>I2 |
| C.Cl2>I2>FeCl3>KMnO4 | D.FeCl3>KMnO4>Cl2>I2 |
根据下列反应的化学方程式,判断有关物质的还原性强弱顺序是
① I2 + SO2 + 2H2O = H2SO4 + 2HI;② 2FeCl2 + Cl2 = 2FeCl3;
③ 2FeCl2 + 2HI = 2FeCl3 + 2HCl +I2
| A.SO2>I->Fe2+>Cl- | B.Cl->Fe2+>SO2>I- |
| C.Fe2+>I->Cl->SO2 | D.I->Fe2+>Cl->SO2 |
下表中对应关系正确的是
| A |
 |
均为取代反应 |
| B |
由油脂得到甘油 由淀粉得到葡萄糖 |
均发生了水解反应 |
| C |
|
均为单质被还原的置换反应 |
| D |
均为水作还原剂的氧化还原反应 |
铋(Bi)是第VA族元素,+5价Bi的化合物氧化性大于MnO4—。某反应中反应物与生成物有:NaMnO4、NaBiO3、Na2SO4、MnSO4、Bi2(SO4)3、H2O和一种未知物X。下列关于该反应的描述中不正确的是
| A.X是H2SO4 |
| B.反应中Mn原子与Bi原子个数比为5:2 |
| C.该反应中NaBiO3作氧化剂 |
| D.该反应中Na2SO4既不是氧化产物,又不是还原产物 |
下列叙述中能肯定A金属比B金属金属性强的是 ( )
| A.A原子的最外层电子数比B原子的最外层电子数少 |
| B.A原子的电子层数比B原子的电子层数多 |
| C.1mol A从酸中置换H+生成的H2比1mol B从酸中置换H+生成的H2多 |
| D.常温时,A能从水中置换出氢,而B不能 |
下列根据实验操作和现象所得出的结论正确的是
| 选项 |
实验操作 |
实验现象 |
结论 |
| A |
向某溶液中加入盐酸酸化的BaCl2溶液 |
生成白色沉淀 |
该溶液中一定含有SO42— |
| B |
将少量的溴水滴入FeCl2、NaI的混合溶液中,再滴加CCl4,振荡、静置,向上层溶液中滴加KSCN溶液。再向上层溶液中滴加溴水 |
实验现象1: 上层溶液不变红, 下层溶液紫红色 实验现象2: 上层溶液变红 |
氧化性:Br2>Fe3+>I2 |
| C |
取久置的Na2O2粉末,向其中滴加过量的盐酸 |
产生无色气体 |
Na2O2没有变质 |
| D |
将一片铝箔置于酒精灯外焰上灼烧 |
铝箔熔化但不滴落 |
铝箔表面有致密Al2O3薄膜,且Al2O3熔点高于Al |
2011年3月18日至19日,受“吃碘盐能防止核辐射”等谣言的影响,我国部分地区出现抢购食盐现象。已知碘盐的主要成分是KIO3和NaCl,KIO3与NaHSO3发生反应:2KIO3 + 6NaHSO3 ="=" 2KI + 3Na2SO4 + 3H2SO4,下列说法中不正确的是
A 23Na37Cl中质子数和中子数之比是8:7 B.KIO3和NaCl都是强电解质
C.KIO3作氧化剂被还原 D.生成1mo1 KI时,转移6 mo1电子
下列实验对应的结论正确的是:
| |
A |
B |
C |
D |
| 装 置 |
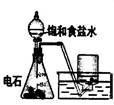 |
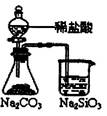 |
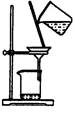 |
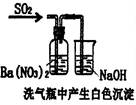 |
| 结 论 |
实验室制取乙炔 |
能证明非金属性 Cl>C>Si |
分离出Cl2与KI溶 液反应生成的碘 |
白色沉淀是BaSO3 |
氧化还原反应中,水的作用可以是氧化剂、还原剂、既是氧化剂又是还原剂、既非氧化剂又非还原剂等。下列反应与Br2+SO2+2H2O=H2SO4+2HBr相比较,水的作用不相同的是
| A.2Na2O2+2H2O=4NaOH+O2↑ |
| B.4Fe(OH)2+O2+2H2O=4Fe(OH)3 |
| C.Cl2+H2O=HCl+HClO |
| D.2Al+2NaOH+2H2O=2NaAlO2+3H2↑ |
NaNO2是一种食品添加剂,既有致癌作用。酸性KMnO4溶液与NaNO2的反应为: +NO2― +H+ =Mn2+ +NO3―+H2O(未配平)。下列叙述正确的是
+NO2― +H+ =Mn2+ +NO3―+H2O(未配平)。下列叙述正确的是
| A.反应中NO2―是氧化剂 | B.反应过程中溶液pH减小 |
| C.1 mol KMnO4可以消耗2.5 mol NaNO2 | D.该反应可以说明氧化性NO3―> |
试题篮
()