在含有n mol FeI2的溶液中通入Cl2,有x mol Cl2发生反应。下列说法正确的是
A.当x ≤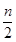 时,反应的离子方程式为:2Fe2++ Cl2 → 2Fe3++ 2Cl- 时,反应的离子方程式为:2Fe2++ Cl2 → 2Fe3++ 2Cl- |
| B.当x ≥ n时,反应的离子方程式为:2Fe2++ 2I-+ 2Cl2 → 2Fe3++ I2+ 4Cl- |
| C.当Fe2+和I-同时被氧化时,x与n的关系为x>n |
| D.当x=n时,反应后氧化产物的物质的量为n mol |
下列说法正确的是()
| A.阳离子只能得电子被还原,阴离子只能失电子被氧化 |
| B.已知①Fe+Cu2+=Fe2++Cu;②2Fe3++Cu=2Fe2++Cu2+,则氧化性强弱顺序为: Fe3+>Cu2+>Fe2+ |
| C.化学反应中,得电子越多的氧化剂,其氧化性就越强 |
| D.已知还原性:B->C->D-,反应2C-+D2=2D-+C2和反应2C-+B2=2B-+C2都能发生 |
溴是海水中重要的非金属元素,地球上90%的溴元素以Br-的形式存在于海水中,所以人们称溴为“海洋元素”。下列有关说法中正确的是
| A.从海水中提取溴时,不涉及氧化还原反应 |
| B.苯与溴水反应生成溴苯 |
| C.可以用CCl4萃取溴水中的溴 |
| D.向FeBr2溶液中通入Cl2时,一定会发生如下反应: |
2Fe2++4Br-+3Cl2=2Fe3++2Br2+6Cl-
已知下述三个实验均能发生化学反应
①将铁钉放入硫酸铜溶液中 ②向硫酸亚铁溶液中滴入几滴双氧水 ③将铜丝放入氯化铁溶液中
下列判断正确的是
| A.实验①中铁钉做氧化剂 | B.实验②中Fe2+具有还原性 |
| C.实验③中发生的是置换反应 | D.上述实验证明氧化性Fe3+>Fe2+>Cu2+ |
铊(Tl)盐与氰化钾(KCN)被列为A级危险品。已知下列反应在一定条件下能够发生:
(1)Tl3++2Ag=Tl++2Ag+
(2)Ag++Fe2+=Ag+Fe3+
(3)Fe+2Fe3+=3Fe2+,
下列离子氧化性比较顺序正确的是
| A.Tl3+>Fe3+>Ag+ | B.Fe3+>Ag+>Tl3+ |
| C.Tl+>Ag+>Fe2+ | D.Tl3+>Ag+>Fe2+ |
有A、B、C、D四种物质,已知它们能发生下列变化:
①A2++B=B2++A ②A2++C=C2++A
③B2++C=C2++B ④C2++D=D2++C
由此可推知,各物质的氧化性、还原性强弱顺序正确的是
①氧化性:A2+>B2+>C2+>D2+
②氧化性:D2+>C2+>B2+>A2+
③还原性:A>B>C>D
④还原性:D>C>B>A
A.①③ B.①④ C.②④ D.②③
下列实验中,依据实验操作及现象,得出的结论正确的是
| |
操作 |
现象 |
结论 |
| A |
将水蒸气通过灼热的铁粉 |
粉末变红 |
铁与水在高温下发生反应 |
| B |
将充满NO2的密闭玻璃球浸泡在热水中 |
红棕色变深 |
反应2NO2(g) N2O4(g);ΔH<0 N2O4(g);ΔH<0 |
| C |
将少量的溴水分别滴入FeCl2溶液、NaI溶液中,再分别滴加CCl4振荡 |
上层分别呈无色和紫红色 |
还原性:I->Br->Fe2+ |
| D |
向溶液X中加入稀盐酸,并将产生的无色气体通入澄清石灰水中 |
生成白色沉淀 |
溶液X中一定含有CO32-或SO32- |
常温下溶液中可发生如下反应:①16H++10Z-+2XO4-=2X2++5Z2+8H2O ②2A2++B2=2A3++2B- ③2B-+Z2=B2+2Z-,由此判断下列说法错误的是( )
| A.反应Z2+2A2+=2A3++2Z-可以进行 |
| B.Z元素在①③反应中均被还原 |
| C.氧化性由强到弱的顺序是XO4-、Z2、B2、A3+ |
| D.还原性由强到弱顺序是A2+、B-、Z-、X2+ |
已知反应:①MnO2+4HCl PbCl2+Cl2↑+2H2O, ②Cu+2Fe3+=Cu2++2Fe2+, ③Cl2+2Fe2+=2Cl-+2Fe3+。则有关物质(离子)的氧化性由强到弱的顺序为
PbCl2+Cl2↑+2H2O, ②Cu+2Fe3+=Cu2++2Fe2+, ③Cl2+2Fe2+=2Cl-+2Fe3+。则有关物质(离子)的氧化性由强到弱的顺序为
| A.Cl2>Fe3+>Cu2+>MnO2 | B.MnO2>Cl2>Fe3+>Cu2+ |
| C.Fe3+>Cu2+>MnO2>Cl2 | D.Cu2+>Fe3+>Cl2>MnO2 |
已知氧化性顺序是:Cl2>Br2>Fe3+>I2,在FeI2和FeBr2混合溶液中,通入一定量Cl2,溶液中存在的离子组不合理的是( )
| A.Fe3+ Br— Cl— | B.Fe2+ Br— Cl— |
| C.Fe2+ Cl— I— | D.Fe2+ Br— Cl— I— |
已知下列实验事实:
①Cr2O3固体既能溶于KOH溶液得到KCrO2溶液,又能溶于硫酸得到Cr2(SO4)3溶液;
②向KCrO2溶液中滴加H2O2溶液,再酸化,可得K2Cr2O7溶液;
③将K2Cr2O7溶液滴加到淀粉和KI的混合溶液中,溶液变蓝。
下列判断正确的是
| A.化合物KCrO2中Cr元素为+3价 |
| B.实验①证明Cr2O3是酸性氧化物 |
| C.实验②证明H2O2既有氧化性又有还原性 |
| D.实验③证明氧化性:Cr2O72- > I2 |
根据下列三个反应判断有关物质(或微粒)还原性由强到弱的顺序是
①H2SO3+I2+H2O=2HI+H2SO4
②2FeCl3+2HI=2FeCl2+2HCl+I2
③3FeCl2+4HNO3=2FeCl3+NO十+2H2O+Fe(NO3)3
| A.H2SO3 >I-> Fe2+ >NO | B.I->Fe2+> H2SO3 >NO |
| C.Fe2+ >I-> H2SO3 >NO | D.NO>Fe2+>H2SO3 >I- |
今已知反应:①Cl2+2KBr=2KCl+Br2,②KClO3 +6HCl=3Cl2+KCl +3H2O,
③2KBrO3 +Cl2=Br2 + 2KClO3,下列说法正确的是
| A.上述三个反应都有单质生成,所以都是置换反应 |
| B.反应②中还原剂与氧化剂的物质的量之比为6∶1 |
| C.氧化性由强到弱顺序为 KBrO3>KClO3>Cl2>Br2 |
| D.③中lmol还原剂反应则氧化剂得到电子的物质的量为2mol |
在一种酸性溶液中可能存在Fe3+、NO3-、Cl-、I-中的一种或几种离子,向溶液中加入溴水,溴单质被还原,由此可推断溶液中
| A.一定含有I-,不能含有Cl- | B.可能含有Cl-、NO3-和I- |
| C.可能含有NO3- | D.不含有Fe3+ |
试题篮
()