已知常温下在溶液里可发生如下两个离子反应:
Ce4++Fe2+===Fe3++Ce3+
Sn2++2Fe3+===2Fe2++Sn4+
由此可以确定Fe3+、Ce4+、Sn4+三种离子的氧化性由强到弱的顺序
| A.Sn4+、Fe3+、Ce4+ | B.Ce4+、Fe3+、Sn4+ |
| C.Sn4+、Ce4+、Fe3+ | D.Fe3+、Sn4+、Ce4+ |
下列说法正确的是
| A.金属原子失电子越多,其还原性越强 |
| B.CH4的摩尔质量为16g |
| C.10 mL质量分数为98%的H2SO4,用水稀释至100 mL,H2SO4的质量分数为9.8% |
| D.电解质物质本身可能导电 |
已知Co2O3在酸性溶液中易被还原成Co2+,其Co2O3、Cl2、FeCl3、I2氧化性依次减弱。下列反应在水溶液中不可能发生的是
| A.3 Cl2 + 6 FeI2 = 4FeI3 + 2FeCl3 |
| B.Cl2 + FeI2 = FeCl3 + I2 |
| C.Co2O3 + 6 HCl = 2CoCl2 + Cl2↑+ 3H2O |
| D.2Fe3+ + 2I— = 2Fe2++ I2 |
若将某种富含维生素C的水果切碎捣烂,加水溶解,提取其滤液就能达到充分提取水果中的维生素c的目的,这说明维生素c 。服用维生素c可使食物中的Fe3+转化成Fe2+,有利于人体吸收,在该化学反应中维生素c体现 。
| A.能溶于水,氧化性 | B.不能溶于水,氧化性 |
| C.能溶于水,还原性 | D.不能溶于水,还原性 |
用FeCl3溶液腐蚀印刷电路板上的铜,所得的溶液中加入铁粉。对加入铁粉充分反应后的溶液分析合理的是
| A.若无固体剩余,则溶液中一定有Fe3+ | B.若溶液中有Cu2+,则一定没有固体析出 |
| C.若有固体存在,则溶液中一定有Fe2+ | D.若溶液中有Fe2+,则一定有Cu析出 |
在常温下,发生下列几种反应:①16H++10Z-+2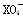 ===2X2++5Z2+8H2O
===2X2++5Z2+8H2O
②2A2++B2===2A3++2B-
③2B-+Z2===B2+2Z-
根据上述反应,下列结论判断错误的是
| A.溶液中可发生:Z2+2A2+===2A3++2Z- |
| B.Z2在①③反应中为氧化剂 |
C.氧化性强弱的顺序为: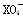 >Z2>B2>A3+ >Z2>B2>A3+ |
D.X2+是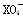 的还原产物 的还原产物 |
已知G、Q、X、Y、Z均为含氯元素的化合物,在一定条件下有下列转化关系(未配平):
①G―→Q+NaCl ②Q+H2O X+H2
X+H2
③Y+NaOH―→G+Q+H2O ④Z+NaOH―→Q+X+H2O
这五种化合物中Cl元素化合价由低到高的顺序是
| A.G、Y、Q、Z、X | B.X、Z、Q、G、Y |
| C.X、Z、Q、Y、G | D.G、Q、Y、Z、X |
根据反应(1)→(4),可以判断下列4个物质的氧化性由强到弱的正确顺序是( )
⑴Cl2+2KI=2KCl+I2; ⑵2FeCl2+Cl2=2FeCl3;
⑶2FeCl3+2HI=2FeCl2+2HCl+I2,⑷H2S+I2=S+2HI;
| A.S>I2>Fe3+>Cl2 | B.Cl2>Fe3+>I2>S |
| C.Fe3+>Cl2>S>I2 | D.Cl2>I2>Fe3+>S |
根据以下几个反应:
①Cl2+2KBr=2KCl+Br2 ②Br2+2KI=2KBr+I2 判断氧化性由强到弱的顺序是( )
| A.I2>Br2>Cl2 | B.Cl2>Br2>I2 | C.Br2>I2>Cl2 | D.Cl2>I2>Br2 |
根据下列化学方程式判断物质氧化性或还原性强弱排序正确的是
① 2FeCl3+Cu=2FeCl2+CuCl2 ②CuCl2+Fe=FeCl2+Cu
| A.还原性:Fe > Cu>FeCl2 | B.还原性:Fe > FeCl2> Cu |
| C.氧化性:CuCl2>FeCl3>FeCl2 | D.氧化性:FeCl3 >FeCl2>CuCl2 |
已知常温下在溶液中可发生如下两个离子反应:Ce4++ Fe2+=Fe3++ Ce3+
Sn2++ 2Fe3+=2Fe2++ Sn4+,由此可以确定Fe2+、Ce3+、Sn2+三种离子的还原性由强到弱的顺序是
| A.Sn2+、Fe2+、Ce3+ | B.Sn2+、Ce3+、Fe2+ |
| C.Ce3+、Fe2+、Sn2+ | D.Fe2+、Sn2+、Ce3+ |
已知下列氧化还原反应:2BrO3-+Cl2==Br2+2ClO3-,5Cl2+I2+6H2O==2IO3-+10Cl-+12H+,
ClO3-+5Cl-+6H+==3Cl2↑+3H2O。上述条件下,各微粒氧化性由强到弱的排列顺序正确的是
| A.ClO3->BrO3->IO3->Cl2 | B.BrO3->Cl2>ClO3->IO3- |
| C.BrO3->ClO3->Cl2>IO3- | D.Cl2>BrO3->ClO3->IO3- |
根据表中信息判断,下列选项不正确的是( )
| 序号 |
反应物 |
产物 |
| ① |
KMnO4、H2O2、H2SO4 |
K2SO4、MnSO4… |
| ② |
Cl2、FeBr2 |
FeCl3、FeBr3 |
| ③ |
MnO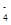 … … |
Cl2、Mn2+… |
A.第①组反应的其余产物为H2O和O2
B.第②组反应中Cl2与FeBr2的物质的量之比为1∶2
C.第③组反应中生成1 mol Cl2,转移电子2 mol
D.氧化性由强到弱顺序为MnO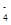 >Cl2>Fe3+>Br2
>Cl2>Fe3+>Br2
稀土是工业味精,邓小平同志说过“中东有石油,我们有稀土”。稀土元素铈(Ce)主要存在于独居石中,金属铈在空气中易氧化变暗,受热时燃烧,遇水很快反应。已知:铈常见的化合价为+3和+4,氧化性:Ce4+>Fe3+。下列说法正确的是 ( )
| A.电解熔融CeO2制Ce,铈在阳极获得 |
B.铈有四种稳定的核素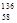 Ce、 Ce、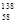 Ce、 Ce、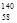 Ce、 Ce、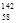 Ce,它们互为同素异形体 Ce,它们互为同素异形体 |
| C.用Ce(SO4)2溶液滴定硫酸亚铁溶液,其离子方程式为:Ce4++Fe2+=Ce3++Fe3+ |
| D.由于氧化性:Ce4+>Fe3+,而I—有强还原性,所以铈溶于氢碘酸的化学方程式可表示为:2Ce+6HI=2CeI3+3H2↑。 |
试题篮
()