(13分)某兴趣小组探究SO2气体还原Fe3+、I2,他们使用的药品和装置如下图所示: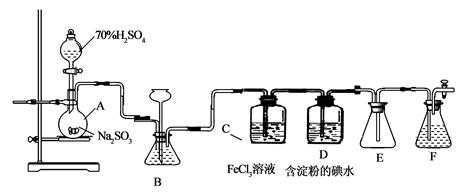
(1)仪器组装完成后,关闭两端活塞,向装置B中的长颈漏斗内注入液体至形成一段液注,若
,则整个装置气密性良好。装置E的作用是 。装置F中为 溶液。
(2)装置B的作用之一是观察SO2的生成速率,其中的液体最好选择 。
| A.蒸馏水 | B.饱和Na2SO3溶液 |
| C.饱和NaHSO3溶液 | D.饱和NaHCO3溶液 |
(3)SO2气体还原Fe3+反应的产物是________________(填离子符号)。
(4)在上述装置中通入过量的SO2为了验证C中SO2与Fe3+发生了氧化还原反应,他们取C中的溶液,分成三份,并设计了如下实验:
方案①:往第一份试液中加入KMnO4溶液,紫红色褪去。
方案②:往第一份试液加入KSCN溶液,不变红,再加入新制的氯水,溶液变红。
方案③:往第二份试液加入用稀盐酸酸化的BaCl2,产生白色沉淀。
上述方案不合理的是____,原因是_______________________________________。
(5)能表明I-的还原性弱于SO2的现象是_________________,写出有关离子方程式:_____________。
为了探究H2O2、H2SO3和Br2氧化性的相对强弱,设计如下实验(夹持仪器已略去)。请回答下列问题: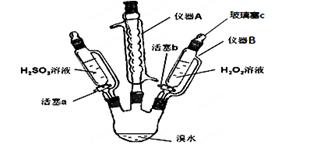
(1)仪器A的名称_________,其作用是___________。
(2)用仪器B滴加液体并不需要打开玻璃塞c,原因是____________________________。
(3)实验记录如下(请补全空白):
| 步骤 |
实验操作 |
实验现象 |
实验结论 |
| Ⅰ |
打开活塞a,逐滴加入H2SO3溶液至过量 |
________________ |
__________________________ |
| Ⅱ |
向步骤Ⅰ所得溶液中逐滴加入H2O2溶液 |
刚开始溶液颜色无明显变化,继续滴加,溶液变为橙黄色 |
__________________________ |
(4)步骤Ⅱ中,开始时颜色无明显变化的原因是(写出一条)_______________________,
步骤Ⅰ中反应的离子方程式_________________________________________________,
步骤Ⅱ中主要反应的离子方程式_____________________________________________。
为验证氧化性Cl2 > Fe3+ > SO2,某小组用下图所示装置进行实验(夹持仪器和A中加热装置已略,气密性已检验)。
实验过程:
I. 打开弹簧夹K1~K4,通入一段时间N2,再将T型导管插入B中,继续通入N2,然后关闭K1、K3、K4。
Ⅱ. 打开活塞a,滴加一定量的浓盐酸,给A加热。
Ⅲ. 当B中溶液变黄时,停止加热,关闭K2。
Ⅳ. 打开活塞b,使约2mL的溶液流入D试管中,检验其中的离子。
Ⅴ. 打开K3和活塞c,加入70%的硫酸,一段时间后关闭K3。
Ⅵ. 更新试管D,重复过程Ⅳ,检验B溶液中的离子。
(1)过程Ⅰ的目的是 。
(2)棉花中浸润的溶液为 。
(3)A中发生反应的化学方程式 。
(4)若将制取的SO2通入酸性高锰酸钾溶液可使溶液褪色,其离子方程式为 。
(5)甲、乙、丙三位同学分别完成了上述实验,结论如下表所示。他们的检测结果一定能够证明氧化性Cl2 > Fe3+ > SO2的是 (填“甲”“乙”“丙”)。
| |
过程ⅣB溶液中含有的离子 |
过程ⅥB溶液中含有的离子 |
| 甲 |
有Fe3+无Fe2+ |
有SO42- |
| 乙 |
既有Fe3+又有Fe2+ |
有SO42- |
| 丙 |
有Fe3+无Fe2+ |
有Fe2+ |
某校化学实验兴趣小组在“探究卤素单质的氧化性”的系列实验中发现:在足量的稀氯化亚铁溶液中,加入1~2滴溴水,振荡后溶液呈黄色。
(1)提出问题:Fe3+、Br2哪一个的氧化性更强?
(2)猜想
①甲同学认为氧化性:Fe3+>Br2,故上述实验现象不是发生化学反应所致,则溶液呈黄色是含
(填化学式,下同)所致。
②乙同学认为氧化性:Br2>Fe3+,故上述实验现象是发生化学反应所致,则溶液呈黄色是含___所致。
3)设计实验并验证
丙同学为验证乙同学的观点,选用下列某些试剂设计出两种方案进行实验,并通过观察实验现象,证明了乙同学的观点确实是正确的。供选用的试剂:
| A.酚酞试液 | B.CCl4 | C.无水酒精 | D.KSCN溶液 |
请你在下列表格中写出丙同学选用的试剂及实验中观察到的现象。(试剂填序号)
| |
选用试剂 |
实验现象 |
| 方案1 |
|
|
| 方案2 |
|
|
(4)应用与拓展
①在足量的稀氯化亚铁溶液中加入l~2滴溴水,溶液呈黄色,所发生的离子反应方程式为
____________________________。
②在FeBr2溶液中通入足量Cl2,所发生的离子反应方程式为 。
为探究H2O2、SO2、Br2氧化性强弱,某小组同学设计如下实验(夹持及尾气处理装置已略去,气密性已检验)。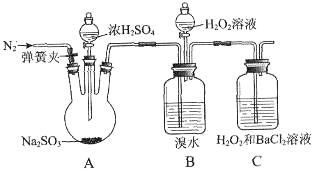
| 实验操作 |
实验现象 |
| ⅰ.打开A中分液漏斗活塞,滴加浓硫酸 |
A中有气泡产生,B中红棕色溴水褪色,C中有白色沉淀 |
| ⅱ.取C中沉淀加入盐酸 |
C中白色沉淀不溶解 |
| ⅲ.打开B中分流漏斗活塞,逐滴滴加H2O2 |
开始时颜色无明显变化;继续滴加H2O2溶液,一段时间后,混合液逐渐变成红棕色 |
(1)A中发生反应的化学方程式是________________________________________。
(2)甲同学通过C中产生白色沉淀,得出结论,氧化性:H2O2>SO2。
①乙同学认为不能得出此结论,认为在滴加浓硫酸之前应增加一步操作,该操作是___________。
②丙同学认为还应该在B和C之间增加洗气瓶D,D中盛放的试剂是____________。
③将乙和丙同学改进后的方案进行实验,C中产生白色沉淀,得出结论:氧化性H2O2>SO2。
(3)ⅲ中滴入少量H2O2没有明显变化。提出假设:
观点1:H2O2的量少不能氧化Br― 观点2:B中有未反应的H2SO3
为验证观点2,应进行的实验操作及现象是___________________________________。
(4)通过上述全部实验,得出结论:H2O2、SO2、Br2氧化性由强到弱的顺序是________。
为验证氧化性Cl2 > Fe3+ > SO2,某小组用下图所示装置进行实验(夹持仪器和A中加热装置已略,气密性已检验)。
实验过程:
I .打开弹簧夹K1~K4,通入一段时间N2,再将T型导管插入B中,继续通入N2,然后关闭K1、K3、K4。
Ⅱ.打开活塞a,滴加一定量的浓盐酸,给A加热。
Ⅲ.当B中溶液变黄时,停止加热,夹紧弹簧夹K2。
Ⅳ.打开活塞b,使约2mL的溶液流入D试管中,检验其中的离子。
Ⅴ.打开弹簧夹K3、活塞c,加入70%的硫酸,一段时间后夹紧弹簧夹K3。
Ⅵ.更新试管D,重复过程Ⅳ,检验B溶液中的离子。
(1) 过程Ⅰ的目的是 。
(2) 棉花中浸润的溶液化学式为 。
(3) A中发生反应的化学方程式为 。
(4)过程Ⅳ中检验其中Fe3+和Fe2+的试剂分别为 和 。
确定有Fe3+和Fe2+现象分别是 和 。
(5) 过程Ⅵ,检验B溶液中是否含有SO42-的操作是 。
(6) 甲、乙、丙三位同学分别完成了上述实验,他们的检测结果一定能够证明氧化性:
| |
过程Ⅳ B溶液中含有的离子 |
过程Ⅵ B溶液中含有的离子 |
| 甲 |
有Fe3+无Fe2+ |
有SO42- |
| 乙 |
既有Fe3+又有Fe2+ |
有SO42- |
| 丙 |
有Fe3+无Fe2+ |
有Fe2+ |
Cl2 > Fe3+ > SO2的是 (填“甲”“乙”“丙”)。
某研究小组对“Br2和I2能否将Fe2+氧化为Fe3+”这一课题进行实验和探究。请你完成相关问题的回答。
(1)提出合理的假设
假设1: Br2和I2都可以将Fe2+氧化为Fe3+;
假设2: Br2和I2都不能将Fe2+氧化为Fe3+;
假设3:
(2)实验验证
在大试管中加适量铁粉,加入10 mL 稀硫酸,振荡试管,充分反应后,铁粉有剩余,将所得的FeSO4溶液稀释到200mL,备用。
实验Ⅰ:向试管1中加入2 mL浅绿色的 FeSO4溶液,再滴加少量红棕色的溴水,振荡试管,溶液为黄色;
实验Ⅱ:向试管2中加入2 mL浅绿色的 FeSO4溶液,再滴加少量棕黄色的碘水,振荡试管,溶液为黄色。
(3)对实验现象的分析与讨论
①甲同学认为实验Ⅰ的现象说明溴水能将Fe2+氧化,离子方程式为 。
②乙同学认为应该补充实验,才能得出甲的结论。乙的实验操作以及预期现象是 。
③该小组同学对实验Ⅱ中溶液呈黄色的原因展开了讨论:
可能1:碘水与 FeSO4溶液不反应,黄色是碘水稀释后的颜色。
可能2: 。
丙同学和丁同学分别设计了以下实验方案以确定可能的原因。
丙方案:向试管2所得溶液中继续加入0.5mLCCl4,充分振荡,静置一段时间后。取出上层溶液,滴加几滴KSCN 溶液;
丁方案:向试管2所得溶液中继续加入加入0.5mL乙酸乙酯,充分振荡,静置一段时间后。取出下层溶液,滴加几滴KSCN 溶液;
你认为 方案为最佳方案,理由是 。
(4)拓展延伸
①为准确测定此实验所用的FeSO4溶液的浓度,某同学补充了以下实验:
滴定:量取20.00mL稀释后得到的溶液于锥形瓶中,将0.0200mol/LKMnO4标准溶液装入50mL中,滴定至终点,记录数据。重复滴定2次。平均消耗KMnO4溶液V mL。
②计算:此实验中所用的FeSO4溶液的物质的量浓度= mol/L(要求只列出算式,不需运算)。
(已知反应式:Fe2+ + MnO4- +H+ — Fe3+ + Mn2+ + H2O,未配平)
某研究小组对“Br2和I2能否将Fe2+氧化为Fe3+”这一课题进行实验和探究。请你完成相关问题的回答。
(1)提出合理的假设
假设1: Br2和I2都可以将Fe2+氧化为Fe3+;
假设2: Br2和I2都不能将Fe2+氧化为Fe3+;
假设3:
(2)实验验证
在大试管中加适量铁粉,加入10 mL 稀硫酸,振荡试管,充分反应后,铁粉有剩余,将所得的FeSO4溶液稀释到200mL,备用。
实验Ⅰ:向试管1中加入2 mL浅绿色的 FeSO4溶液,再滴加少量红棕色的溴水,振荡试管,溶液为黄色;
实验Ⅱ:向试管2中加入2 mL浅绿色的 FeSO4溶液,再滴加少量棕黄色的碘水,振荡试管,溶液为黄色。
(3)对实验现象的分析与讨论
①甲同学认为实验Ⅰ的现象说明溴水能将Fe2+氧化,离子方程式为 。
②乙同学认为应该补充实验,才能得出甲的结论。乙的实验操作以及预期现象是 。
③该小组同学对实验Ⅱ中溶液呈黄色的原因展开了讨论:
可能1:碘水与 FeSO4溶液不反应,黄色是碘水稀释后的颜色。
可能2: 。
丙同学和丁同学分别设计了以下实验方案以确定可能的原因。
丙方案:向试管2所得溶液中继续加入0.5mLCCl4,充分振荡,静置一段时间后。取出上层溶液,滴加几滴KSCN 溶液;
丁方案:向试管2所得溶液中继续加入加入0.5mL乙酸乙酯,充分振荡,静置一段时间后。取出下层溶液,滴加几滴KSCN 溶液;
你认为 方案为最佳方案,理由是 。
(4)拓展延伸
①为准确测定此实验所用的FeSO4溶液的浓度,某同学补充了以下实验:
滴定:量取20.00mL稀释后得到的溶液于锥形瓶中,将0.0200mol/LKMnO4标准溶液装入50mL中,滴定至终点,记录数据。重复滴定2次。平均消耗KMnO4溶液V mL。
②计算:此实验中所用的FeSO4溶液的物质的量浓度= mol/L(要求只列出算式,不需运算)。
(已知反应式:Fe2+ + MnO4- +H+ — Fe3+ + Mn2+ + H2O,未配平)
某校化学实验兴趣小组在“探究卤素单质的氧化性”的系列实验中发现,在足量的稀氯化亚铁溶液中,加入1~2滴溴水,振荡后溶液呈黄色。
(1)提出问题:Fe3+、Br2谁的氧化性更强?
(2)提出猜想:
①甲同学认为氧化性:Fe3+>Br2,故上述实验现象不是发生化学反应所致,则溶液呈黄色是因为含有 (填化学式,下同)。
②乙同学认为氧化性:Br2>Fe3+,故上述实验现象是发生化学反应所致,则溶液呈黄色是因为含有 。
(3)设计实验并验证:丙同学为验证乙同学的观点,选用下列某些试剂设计出两种方案进行实验,并通过观察实验现象,证明了乙同学的观点是正确的。
供选用的试剂:
a.酚酞试液 b.四氯化碳 c.无水酒精 d.硫氰化钾溶液
请你在下列表格中写出丙同学选用的试剂及实验中观察到的现象(试剂填序号)。
| |
选用试剂 |
实验现象 |
| 方案1 |
|
|
| 方案2 |
|
|
(4)应用与拓展:
①在足量的稀氯化亚铁溶液中,加入1~2滴溴水,溶液呈黄色,所发生的反应的离子方程式为 。
②在100 mL FeBr2溶液中通入2.24 L Cl2(标准状况),溶液中有 的Br-被氧化成Br2,则原FeBr2溶液中FeBr2的物质的量浓度为 。
的Br-被氧化成Br2,则原FeBr2溶液中FeBr2的物质的量浓度为 。
某课外小组学生对Cl2与FeBr2溶液反应进行实验探究。
| 操 作 |
现 象 |
| 取0.1 mol/L的FeBr2溶液10 mL,测溶液的pH |
pH试纸变红(约为4) |
 |
ⅰ.开始通入100 mL(折合标准状况),溶液由浅绿色逐渐变黄; ⅱ.稍后,继续通入Cl2,溶液黄色加深,变为棕黄色; iii.稍后,溶液由棕黄色变浅,最终变为黄色 |
(1)用浓盐酸和MnO2反应制取Cl2的化学方程式是 。
(2)pH≈4的原因是 (用化学用语表示)。
(3)现象i中溶液由浅绿色逐渐变黄。某学生猜测可能原因:①Cl2将Fe2+氧化为Fe3+,使溶液呈黄色;②Cl2将Br-氧化为Br2,使溶液呈黄色。证明原因①的实验方案是 ;证明原因②的实验方案是 。
(4)现象ⅱ中,溶液变为棕黄色。部分学生猜测①:可能是Cl2先将Fe2+氧化生成Fe3+,Cl2又继续氧化Br-生成Br2。部分学生猜测②:可能是Cl2先将Fe2+氧化生成Fe3+,Fe3+将Br-氧化生成Br2。某学生设计实验进行验证,请完成下列表格:
由此实验得出的结论是 。
| 试管 |
操作 |
现象 |
结论 |
| a |
取2 mL FeCl2溶液,滴加少量氯水、2滴KSCN溶液,振荡 |
|
Cl2的氧化性强于Fe3+ |
| b |
取2 mL FeCl3溶液,滴加少量溴化钠溶液和少量CCl4,振荡 |
CCl4层没有明显变化 |
|
| c |
|
CCl4层由无色变为橙黄色 |
Cl2的氧化性强于Br2 |
为验证卤素单质氧化性的相对强弱,某小组用下图所示装置进行实验(夹持仪器已略去,气密性已检验)。
实验过程:
Ⅰ.打开弹簧夹,打开活塞a,滴加浓盐酸。
Ⅱ.当B和C中的溶液都变为黄色时,夹紧弹簧夹。
Ⅲ.当B中溶液由黄色变为棕红色时,关闭活塞a。
Ⅳ.……
(1)A中产生黄绿色气体,其化学方程式是 。
(2)验证氯气的氧化性强于碘的实验现象是 。
(3)B中溶液发生反应的离子方程式是 。
(4)为验证溴的氧化性强于碘,过程Ⅳ的操作和现象是 。
(5)过程Ⅲ实验的目的是 。
(6)氯、溴、碘单质的氧化性逐渐减弱的原因:同主族元素从上到下 ,得电子能力逐渐减弱。
某化学兴趣小组在探究卤素单质的氧化性的实验中发现,在足量的氯化亚铁溶液中,加入1~2滴溴水,振荡后溶液呈黄色,原因是什么?Br2能否氧化Fe2+,Fe3+与Br2谁的氧化性更强?
(1)甲同学认为:Br2不能氧化Fe2+,Fe3+的氧化性大于Br2,产生上述现象的原因不是化学反应所致,溶液呈黄色是含 (填化学式,下同)所致。
(2)乙同学认为:Br2将Fe2+氧化为Fe3+,Fe3+的氧化性小于Br2,产生上述现象的原因是化学反应所致,则溶液呈黄色是含 所致。
(3)丙同学为验证乙同学的观点,选择下列试剂,设计出两种方案进行实验,并通过观察实验现象,证明了乙同学的观点是正确的,供选用的试剂:a.酚酞试剂;b.CCl4;c.无水酒精;d.KSCN溶液。请你在下表中写出丙同学选用的试剂及实验中观察到的现象。(试剂填序号)
| 选用试剂 |
实验现象 |
| 方案1 |
|
| 方案2 |
|
(4)氧化性:Br2>Fe3+,故在FeCl2中滴入1~2滴溴水,溶液呈黄色。发生反应的离子方程式是 。
(5)根据上述实验推测,若在稀溴化亚铁溶液中通入氯气,首先被氧化的离子是 。在100 mL FeBr2溶液中通入2.24 L Cl2(标准状况),溶液中有 的Br-被氧化成单质Br2,则原FeBr2溶液的物质的量浓度是 。
的Br-被氧化成单质Br2,则原FeBr2溶液的物质的量浓度是 。
某化学小组在学习元素周期律后,对教材中Fe2+氧化为Fe3+的实验进一步思考,并提出问题:Cl2能将Fe2+氧化为Fe3+,那么Br2和I2能否将Fe2+氧化为Fe3+?
环节一:理论推测
部分同学认为Br2和I2都可能将Fe2+氧化为Fe3+,他们思考的依据是________。
部分同学认为Br2和I2都不能将Fe2+氧化为Fe3+,还有同学认为Br2能将Fe2+氧化为
Fe3+而I2不能。他们思考的依据是从上到下卤素单质氧化性减弱。
环节二:设计实验进行验证
在大试管中加适量铁粉,加入10 mL稀盐酸,振荡试管,充分反应后,铁粉有剩余,取上层清液进行下列实验:。
实验1:
| 试管 |
操作 |
现象 |
| ① |
先向试管中加入2 mL FeCl2溶液,再滴加少量红棕色的溴水,振荡试管 |
溶液为黄色 |
| ② |
先向试管中加入2 mL FeCl2溶液,再滴加少量棕黄色的碘水,振荡试管 |
溶液为黄色 |
环节三:实验现象的分析与解释
(1)同学甲认为①中现象说明溴水能将Fe2+氧化,离子方程式为________。
同学乙认为应该补充实验,才能得出同学甲的结论。请你帮助同学乙完成实验:
实验2:
| 操作 |
应该观察到的现象 |
(2)该小组同学对②中溶液呈黄色的原因展开了讨论:
可能1:碘水与FeCl2溶液不反应,黄色是碘水稀释后的颜色。
可能2:______________。
实验3:进行实验以确定可能的原因。
| 操作 |
现象 |
| 向试管②所得溶液中继续加入0.5 mL CCl4,充分振荡,静置一段时间后。取出上层溶液,滴KSCN溶液 |
静置后,上层溶液几乎无色,下层溶液为紫色;上层溶液滴加KSCN溶液后,出现浅红色 |
同学丙认为该实验现象可以说明是“可能2”成立,同学丁认为不严谨,于是设计了实验4:
实验4:
| 操作 |
现象 |
| 向另一支试管中加入2 mL FeCl2溶液,滴加0.5 mL碘水后,再加入0.5 mL乙酸乙酯,充分振荡,静置一段时间后。取出下层溶液,滴加KSCN溶液 |
静置后,上层溶液为紫色,下层溶液几乎无色;下层溶液滴加KSCN溶液后,没有出现浅红色 |
你认为实验4设计的主要目的是________________。
同学丁根据实验4现象得出结论:在本次实验条件下,碘水与FeCl2溶液反应的程度很小。
(3)Cl2、Br2、I2氧化Fe2+的能力逐渐减弱,用原子结构解释原因:__________。
食盐中含有一定量的镁、铁等杂质,加碘盐中碘的损失主要是由于杂质、水分、空气中的氧气以及光照、受热而引起的。已知:
氧化性:IO3->Fe3+>I2;还原性:S2O32->I-
3I2+6OH-=IO3-+5I-+3H2O;KI+I2 KI3
KI3
(1)某学习小组对加碘盐进行如下实验:取一定量某加碘盐(可能含有KIO3、KI、Mg2+、Fe3+),用适量蒸馏水溶解,并加稀盐酸酸化,将所得试液分为3份。第一份试液中滴加KSCN溶液后显红色;第二份试液中加足量KI固体,溶液显淡黄色,用CCl4萃取,下层溶液显紫红色;第三份试液中加入适量KIO3固体后,滴加淀粉试剂,溶液不变色。
①加KSCN溶液后显红色,该红色物质是_____________(用化学式表示);CCl4中显紫红色的物质是___________(用电子式表示)。
②第二份试液中加入足量KI固体后,反应的离子方程式为_______________________________________、__________________________________________________________________。
(2)KI作为加碘剂的食盐在保存过程中,由于空气中氧气的作用,容易引起碘的损失。
写出潮湿环境下KI与氧气反应的化学方程式:_____________________。
将I2溶于KI溶液,在低温条件下,可制得KI3·H2O。该物质作为食盐加碘剂是否合适?___________ (填“是”或“否”),并说明理由_________________________________________________。
(3)为了提高加碘盐(添加KI)的稳定性,可加稳定剂减少碘的损失。下列物质中有可能作为稳定剂的是_______。
| A.Na2S2O3 | B.AlCl3 | C.Na2CO3 | D.NaNO2 |
(4)对含Fe2+较多的食盐(假设不含Fe3+),可选用KI作为加碘剂。请设计实验方案,检验该加碘盐中的Fe2+____________________________________________________________________________________。
某化学小组在学习元素周期律知识后,对教材中Cl2将Fe2+氧化成Fe3+的实验进一步思考,并提出问题:Cl2能将Fe2+氧化成Fe3+,那么Br2和I2能否将Fe2+氧化成Fe3+?
环节一:理论推测。
部分同学认为Br2和I2都能将Fe2+氧化成Fe3+,依据是____________________
_________________________________________________________________。
部分同学认为Br2和I2都不能将Fe2+氧化成Fe3+。还有同学认为Br2能将
Fe2+氧化成Fe3+,而I2不能,依据是同一主族从上到下卤素单质的氧化性逐渐减弱。
环节二:设计实验进行验证。
向大试管中加入适量铁粉,加入10 mL稀盐酸,振荡试管,充分反应后,铁粉有剩余,取上层清液进行下列实验。
实验1:
| 试管 |
操作 |
现象 |
| ① |
先向试管中加入2 mL新制的FeCl2溶液,再向试管中滴加少量红棕色的溴水,振荡试管 |
溶液为 黄色 |
| ② |
先向试管中加入2 mL新制的FeCl2溶液,再向试管中滴加少量棕黄色的碘水,振荡试管 |
溶液为 黄色 |
环节三:实验现象的分析与解释。
(1)甲同学认为试管①中的现象说明溴水能将Fe2+氧化,反应的离子方程式为_________________________________________________________________。
乙同学认为应该补做实验,才能得出甲同学的结论。请你帮助乙同学完成实验:
实验2:
| 操作 |
现象 |
| |
|
(2)该小组同学对试管②中所得的溶液呈黄色的原因展开讨论,并提出了两种假设:
假设1:碘水与FeCl2溶液不反应,黄色是碘水稀释后的颜色。
假设2.________________。
实验3:进行实验以判断假设是否成立。
| 操作 |
现象 |
| 向试管②所得的溶液中继续加入0.5 mL CCl4,充分振荡,静置一段时间。取出上层溶液,滴加KSCN溶液 |
静置后,上层溶液几乎无色,下层溶液为紫色;取上层溶液滴加KSCN溶液后,溶液呈浅红色 |
丙同学认为实验3的现象可以说明假设2成立,丁同学认为不严谨,于是设计了实验4继续探究。
实验4:
| 操作 |
现象 |
| 向另一支试管中加入2 mL新制的FeCl2溶液,滴加0.5 mL碘水后,再加入0.5 mL乙酸乙酯,充分振荡,静置一段时间。取出下层溶液,滴加KSCN溶液 |
静置后,上层溶液为紫色,下层溶液几乎无色;取下层溶液,向其中滴加KSCN溶液后,溶液没有呈浅红色 |
你认为实验4中加入乙酸乙酯的主要目的是___________________________。
丁同学根据实验4的现象得出结论:在本次实验条件下,碘水与FeCl2溶液反应的程度很小。
(3)Cl2、Br2、I2氧化Fe2+的能力逐渐减弱,从原子结构角度解释原因:______________________________________________________________________。
试题篮
()