用0.1 mol·L-1 NaOH溶液分别滴定体积均为20 mL、浓度均为0.1 mol·L-1 HCl溶液和HX溶液,溶液的pH随加入NaOH溶液体积变化如图:

(1)HX为 酸(填“强”或“弱”)。
(2)N点pH>7的原因是(用化学用语表示)______________。
(3)下列说法正确的是__________(填字母)。
a. M点c(HX)<c(X-)
b. M点c(Na+)>c(OH-)
c. P点c(Cl-)=0.05 mol·L-1
浓度均为0.10mol/L、体积均为v0的MOH和ROH溶液,分别加水稀释至体积v,pH随 的变化如图所示,下列叙述错误的是
的变化如图所示,下列叙述错误的是
| A.MOH的碱性强于ROH的碱性 |
| B.ROH的电离程度:b点大于a点 |
| C.若两溶液无限稀释,则它们的c(OH-)相等 |
D.当 =2时,若两溶液同时升高温度, 则c(M+)/c(R+)增大 =2时,若两溶液同时升高温度, 则c(M+)/c(R+)增大 |
一只规格为a mL的滴定管,其尖嘴部分充满溶液,管内液面在m mL处,当液面降到n mL处时,下列判断正确的是( )
| A.流出溶液的体积为(m-n) mL | B.流出溶液的体积为(n-m) mL |
| C.管内溶液体积等于(a-n) mL | D.管内溶液体积多于n mL |
25℃下,0.1mol/L的Na2S溶液,下列叙述正确的是
| A.升高温度,溶液的pH降低 |
| B.加入NaOH固体,溶液中的c(Na+)、c(S2-﹣)均增大 |
| C.c(Na+)>c(OH﹣)>c(S2-﹣)>c(H+) |
| D.2c(Na+)=c(S2-﹣)+c(HS﹣)+c(H2S) |
已知HCN的电离常数K=6.2×10﹣10。用物质的量都是0.1mol的HCN和NaCN混合后配成1L溶液,经测定溶液呈碱性.则下列关系式正确的是( )
| A.c(CN﹣)>c(Na+) | B.c(CN﹣)>c(HCN) |
| C.c(HCN)+c(CN﹣)=0.2mol·L﹣1 | D.c(CN﹣)+c(OH﹣)="0.1" mol·L﹣1 |
(1)常温下,0.1 mol/L的醋酸和0.1 mol/L的盐酸各100 mL,分别与足量的锌粒反应,产生的气体体积前者 后者(填“<”、“>”或“=”).
(2)将体积和物质的量浓度都相同的醋酸和氢氧化钠溶液混合后,溶液呈 性(填“酸”,“中”或“碱”下同),溶液中 c(Na+ ) c(CH3 COO- )(填“ >” 或“=”或“<”,下同 )。
(3)pH=3的醋酸和pH=11的氢氧化钠溶液等体积混合后溶液呈 性,溶液中c(Na+) c(CH3COO- )
(4)用Al2(SO4)3 与NaHCO3 溶液混合反应就是泡沫灭火器的工作原理,请写出反应的离子方程式___________。
常温下MOH和ROH两种一元碱的溶液分别加水稀释时,pH变化如图所示.下列叙述中不正确的是 ( )

| A.ROH是一种强碱,MOH是一种弱碱 |
| B.在x点,c(M+)=c(R+) |
| C.稀释前,c(ROH)<10c(MOH) |
| D.稀释前,c(ROH)=10c(MOH) |
常温下,下列混合溶液的pH一定大于7的是
| A.0.01mol/L的盐酸和0.01mol/L的NaOH溶液等体积混合 |
| B.pH=3的盐酸和pH=11的氨水溶液等体积混合 |
| C.0.01mol/L的盐酸和0.01mol/L的氨水溶液等体积混合 |
| D.pH=3的醋酸和pH=11的NaOH溶液等体积混合 |
下列关于pH相同的盐酸和醋酸溶液的说法正确的是 ( )
| A.中和相同体积的两种酸溶液所需NaOH的物质的量相同 |
| B.加入等质量的锌粉,反应过程中放出H2的速率相同 |
| C.两种溶液中由水电离出来的c(H+)不相同 |
| D.分别用蒸馏水稀释相同倍数后,盐酸的pH大于醋酸的pH |
下列说法不正确的是( )
| A.用10mL量筒量取6.8mL稀H2SO4 |
| B.用碱式滴定管量取15.80mLKMnO4溶液 |
| C.酸碱中和滴定时,滴定管需用标准液或待测液润洗 |
| D.中和热测定时,氢氧化钠溶液稍过量的目的是为了保证盐酸完全被中和 |
常温下,将四种不同的一元酸(用 HA 代表)分别和 NaOH 溶液等体积混合。 两种溶液的物质的量浓度和混合溶液的 pH 如下表所示:
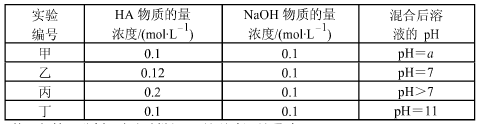
(1)从甲组情况分析,如何判断 HA 是强酸还是弱酸?________________。
(2)乙组混合溶液中粒子浓度 c(A-)和 c(Na+)的大小关系_____________。
A.前者大 B.后者大 C.两者相等 D.无法判断
(3)从丙组实验结果分析,该混合溶液中离子浓度由大到小的顺序是:___________
(4)分析丁组实验数据,写出混合溶液中下列算式的精确结果(列式):c(Na+)-c(A-)=_______mol·L-1。
(5) 某二元酸(化学式用 H2B 表示)在水中的电离方程式是:
H2B===H++HB- HB- H++B2-
H++B2-
回答下列问题:
在 0.1 mol·L-1的 Na2B 溶液中,下列粒子浓度关系式正确的是________。
A.c(B2-)+c(HB-)=0.1 mol·L-1
B.c(B2-)+c(HB-)+c(H2B)=0.1 mol·L-1
C.c(OH-)=c(H+)+c(HB-)
D.c(Na+)+c(H+)=c(OH-)+c(HB-)
常温下,用0.01mol·L-1NaOH溶液滴定20.00mL0.01mol·L-1CH3COOH溶液,所得滴定曲线如右图。下列说法正确的是
| A.a点对应溶液的pH=2 |
| B.b点对应的溶液中:c(OH-)+c(CH3COO-)=c(Na+)+c(H+) |
| C.c点表示NaOH溶液与CH3COOH溶液恰好完全反应 |
| D.d点对应的溶液中,水的电离程度小于同温下纯水的电离程度 |
下列关于pH变化的判断正确的是
| A.温度升高,Na2CO3溶液pH减小 |
| B.氢氧化钠溶液久置于空气中,溶液pH变大 |
| C.新制氯水经光照一段时间后,溶液pH减小 |
| D.温度升高,纯水pH增大 |
将纯水加热至较高温度,下列叙述正确的是
| A.水的离子积变大、pH变小、呈酸性 |
| B.水的离了积不变、pH不变、呈中性 |
| C.水的离子积变小、pH变大、呈碱性 |
| D.水的离子积变大、pH变小、呈中性 |
试题篮
()