现有常温下的四份溶液: ① 0.01 mol/L CH3COOH ② 0.01 mol/LHCl ③pH=12的氨水 ④ pH=12的NaOH溶液,下列说法正确的是
| A.①中水的电离程度最小,③中水的电离程度最大 |
| B.将四份溶液稀释相同倍数后,溶液的pH:②﹥①,③﹥④ |
| C.将②③混合,若pH=7,则消耗溶液的体积:②﹥③ |
| D.将①、④混合,若有c(CH3COO-)﹥c(H+),则混合液一定呈碱性 |
MOH和ROH两种一元碱,常温下其水溶液分别加水稀释时,pH变化如下图。下列说法正确的是
| A.在X点时,由H2O电离出的c(H+)相等,c(M+) = c(R+) |
| B.稀释前,c(ROH)=10c(MOH) |
| C.稀释前的ROH与等体积pH=1的H2SO4混合后所得溶液显酸性 |
| D.等体积等浓度的MOH和HCl混合后,溶液中离子浓度大小关系:c(Cl-)>c(M+)>c(OH-)>c(H+) |
在下列的各种叙述中,正确的是( )
| A.在任何条件下,纯水的pH=7 | B.在任何条件下,纯水都呈中性 |
| C.在100℃时,纯水的pH>7 | D.在100℃时,纯水中c(H+)<10-7mol/L |
下列实验误差分析正确的是
| A.用湿润的pH试纸测稀碱液的pH,测定值偏大 |
| B.用容量瓶配制溶液,定容时俯视刻度线,所配溶液浓度偏小 |
| C.滴定前滴定管内无气泡,终点读数时有气泡,所测体积偏小 |
| D.测定中和反应反的应热时,将碱缓慢倒入酸中,所测温度值偏大 |
下列关于25℃的NaHCO3溶液的相关事实,能够证明H2CO3为弱酸的是
| A.溶液中存在CO32- | B.溶液中c(H+)·c(OH-)=10-14 |
| C.与等物质的量的NaOH恰好中和 | D.溶液中c(Na+)>c(CO32-) |
25℃时,将氨水逐滴加入到稀硫酸中,当溶液的pH=7时,下列关系正确的是
| A.[NH4+]=[SO42-] | B.[NH4+]>[SO42-] |
| C.[NH4+]<[SO42-] | D.[OH-]+[SO42-]=[H+]+[NH4+] |
用0.1 mol·L-1 NaOH溶液分别滴定体积均为20 mL、浓度均为0.1 mol·L-1 HCl溶液和HX溶液,溶液的pH随加入NaOH溶液体积变化如图:

(1)HX为 酸(填“强”或“弱”)。
(2)N点pH>7的原因是(用化学用语表示)______________。
(3)下列说法正确的是__________(填字母)。
a. M点c(HX)<c(X-)
b. M点c(Na+)>c(OH-)
c. P点c(Cl-)=0.05 mol·L-1
某学生用碱式滴定管量取0.1 mol•L-1的NaOH溶液,开始时仰视液面读数为1.00mL,取出部分溶液后,俯视液面,读数为11.00mL,该同学在操作中实际取出的液体体积为( )

| A.大于10.00mL | B.小于10.00mL |
| C.等于10.00mL | D.不能确定 |
浓度均为0.10mol/L、体积均为v0的MOH和ROH溶液,分别加水稀释至体积v,pH随 的变化如图所示,下列叙述错误的是
的变化如图所示,下列叙述错误的是
| A.MOH的碱性强于ROH的碱性 |
| B.ROH的电离程度:b点大于a点 |
| C.若两溶液无限稀释,则它们的c(OH-)相等 |
D.当 =2时,若两溶液同时升高温度, 则c(M+)/c(R+)增大 =2时,若两溶液同时升高温度, 则c(M+)/c(R+)增大 |
常温下,将四种不同的一元酸(用 HA 代表)分别和 NaOH 溶液等体积混合。 两种溶液的物质的量浓度和混合溶液的 pH 如下表所示:
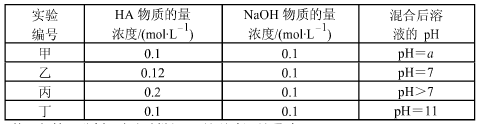
(1)从甲组情况分析,如何判断 HA 是强酸还是弱酸?________________。
(2)乙组混合溶液中粒子浓度 c(A-)和 c(Na+)的大小关系_____________。
A.前者大 B.后者大 C.两者相等 D.无法判断
(3)从丙组实验结果分析,该混合溶液中离子浓度由大到小的顺序是:___________
(4)分析丁组实验数据,写出混合溶液中下列算式的精确结果(列式):c(Na+)-c(A-)=_______mol·L-1。
(5) 某二元酸(化学式用 H2B 表示)在水中的电离方程式是:
H2B===H++HB- HB- H++B2-
H++B2-
回答下列问题:
在 0.1 mol·L-1的 Na2B 溶液中,下列粒子浓度关系式正确的是________。
A.c(B2-)+c(HB-)=0.1 mol·L-1
B.c(B2-)+c(HB-)+c(H2B)=0.1 mol·L-1
C.c(OH-)=c(H+)+c(HB-)
D.c(Na+)+c(H+)=c(OH-)+c(HB-)
常温下,用0.01mol·L-1NaOH溶液滴定20.00mL0.01mol·L-1CH3COOH溶液,所得滴定曲线如右图。下列说法正确的是
| A.a点对应溶液的pH=2 |
| B.b点对应的溶液中:c(OH-)+c(CH3COO-)=c(Na+)+c(H+) |
| C.c点表示NaOH溶液与CH3COOH溶液恰好完全反应 |
| D.d点对应的溶液中,水的电离程度小于同温下纯水的电离程度 |
下列关于pH变化的判断正确的是
| A.温度升高,Na2CO3溶液pH减小 |
| B.氢氧化钠溶液久置于空气中,溶液pH变大 |
| C.新制氯水经光照一段时间后,溶液pH减小 |
| D.温度升高,纯水pH增大 |
将纯水加热至较高温度,下列叙述正确的是
| A.水的离子积变大、pH变小、呈酸性 |
| B.水的离了积不变、pH不变、呈中性 |
| C.水的离子积变小、pH变大、呈碱性 |
| D.水的离子积变大、pH变小、呈中性 |
用pH试纸测定某无色溶液的pH值时,规范的操作是( )
| A.将pH试纸放入溶液中观察其颜色变化,跟标准比色卡比较; |
| B.将溶液倒在pH试纸上,跟标准比色卡比较; |
| C.用干燥的洁净玻璃棒蘸取溶液,滴在pH试纸上,跟标准比色卡比较; |
| D.在试管内放入少量溶液,煮沸,把pH试纸放在管口,观察颜色,跟标准比色卡比较; |
某科研小组设计出利用工业废酸(10%H2SO4)来堆浸某废弃的氧化铜锌矿制取活性ZnO的方案,实现废物综合利用,方案如图所示。

已知:298K时各离子开始沉淀及完全沉淀时的pH如下表所示。
| 离子 |
开始沉淀时的pH |
完全沉淀时的pH |
| Fe2+ |
6.34 |
9.7 |
| Fe3+ |
1.48 |
3.2 |
| Zn2+ |
6.2 |
8.0 |
请回答下列问题:(1)氧化铜锌矿中含有少量的CuS和ZnS,在H2SO4的作用下ZnS可以溶解而CuS不溶,这是由于相同温度下:Ksp(CuS) Ksp(ZnS)(选填“>”“<”或“=”)。
(2)你认为在除铁过程中选用下列物质中的 (填序号)作为试剂甲是比较合适的。
A.KMnO4 B.HNO3 C.H2O2 D.Cl2
(3)除铁过程中加入氨水的目的是调节溶液的pH,pH应控制在 范围之间。
(4)请写出加甲物质后,加入氨水控制调节溶液的pH生成Fe(OH)3反应的离子方程式 。
(5)298K时残留在乙溶液中的c(Fe3+)在 mol/L以下。Fe(OH)3的KSP= 2.70×10-39
(6)乙的溶液可直接用作氮肥,则乙的化学式是 。
(7)请写出“沉淀Zn2+”步骤中发生反应的化学方程式
试题篮
()