如图是一种综合处理SO2废气的工艺流程.若每步反应都完全,下列说法正确的是(设反应过程中溶液的体积不变)
| A.溶液B中发生的反应为:2SO2+O2→2SO3 |
| B.由反应过程可推知氧化性:O2>Fe3+>SO42﹣ |
| C.溶液的pH:A>B>C |
| D.A溶液到C溶液,Fe3+浓度变大 |
常温下用蒸馏水稀释0.1 mol/L醋酸时,始终保持增大趋势的是
| A.溶液中的c(CH3COO-) | B.溶液中的c(H+) |
| C.醋酸的电离平衡常数 | D.溶液中的c(OH-) |
常温下,两种酸的电离平衡常数如下表:
| 酸 |
电离常数K1 |
电离常数K2 |
| H2SO3 |
1.54×10-2 |
1.02×10-7 |
| H2CO3 |
4.3×10-7 |
5.6×10-11 |
常温下,浓度均为0.1 mol/L的下列溶液:①Na2SO3;②Na2CO3;③NaHSO3,下列有关说法正确的是
A.pH:Na2CO3溶液小于Na2SO3溶液
B.结合H+能力:CO32¯弱于SO32¯
C.NaHSO3溶液显酸性的原因是: NaHSO3="==" Na+ + H+ + SO32¯
D.①与②溶液等体积混合后的溶液中:c(SO32-) > c(CO32-) > c(HCO3-) > c(HSO3-)
在25℃时将pH=11的NaOH 溶液与pH=3的CH3COOH溶液等体积混合后,下列关系式中正确的是
| A.c(Na+)=c(CH3COO﹣)+c(CH3COOH) |
| B.c(H+)=c(CH3COO﹣)+c(OH﹣) |
| C.c(Na+)>c(CH3COO﹣)>c(OH﹣)>c(H+) |
| D.c(CH3COO﹣)>c(Na+)>c(H+)>c(OH﹣) |
已知:正盐A强热可得到B、C、D、E四种物质,B通常情况下为无色无味液体,E、F 是空气主要成分,D能产生酸雨,I为红棕色气体,C与J反应可得A,J、K为两种常见的酸。物质之间的转化关系如图所示(图中部分反应物或生成物及反应条件未列出)。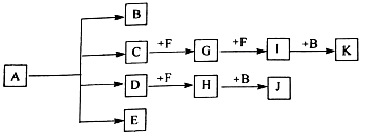
请回答下列问题:
(1)C、E分别是___________、___________。
(2)写出A强热分解生成B、C、D、E的化学方程式_________________。
(3)写出D通人FeCl3溶液时,发生反应的离子方程式_________________。
(4)—定浓度J、K混合后的稀溶液200mL,平均分成两份。向其中一份中逐渐加入铜粉,最多能溶解a g(产生气体只为G)。向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如图所示。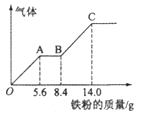
则①a=___________g,②生成的气体G标准状况下体积为___________,③J的物质的量浓度为_________。
下列操作会促进H2O的电离,且使溶液pH>7的是:
| A.将纯水加热到90 ℃ | B.向水中加少量Na2CO3固体 |
| C.向水中加少量NaOH固体 | D.向水中加少量FeCl3固体 |
室温下某溶液中由水电离产生的c(H+)等于10-13 mol·L-1,该溶液的溶质不可能是( )
| A.NaHSO4 | B.NaCl | C.HCl | D.Ba(OH)2 |
下列叙述正确的是
| A.100℃纯水在pH=6,所以水在100℃时呈酸性 |
| B.pH=3的盐酸溶液,稀释至10倍后pH>4 |
| C.0.2mol·L-1的醋酸与等体积水混合后pH=1 |
| D.pH=3的盐酸与pH=11的氢氧化钠等体积混合后pH=7 |
酸碱完全中和时( )
| A.酸和碱的物质的量一定相等 |
| B.酸所提供的H+与碱提供的OH-的物质的量相等 |
| C.酸和碱的物质的量浓度相等 |
| D.溶液一定呈中性 |
常温下,将四种不同的一元酸(用 HA 代表)分别和 NaOH 溶液等体积混合。 两种溶液的物质的量浓度和混合溶液的 pH 如下表所示:
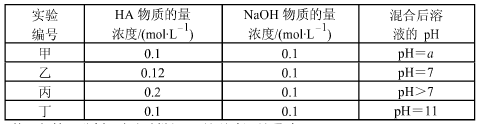
(1)从甲组情况分析,如何判断 HA 是强酸还是弱酸?________________。
(2)乙组混合溶液中粒子浓度 c(A-)和 c(Na+)的大小关系_____________。
A.前者大 B.后者大 C.两者相等 D.无法判断
(3)从丙组实验结果分析,该混合溶液中离子浓度由大到小的顺序是:___________
(4)分析丁组实验数据,写出混合溶液中下列算式的精确结果(列式):c(Na+)-c(A-)=_______mol·L-1。
(5) 某二元酸(化学式用 H2B 表示)在水中的电离方程式是:
H2B===H++HB- HB- H++B2-
H++B2-
回答下列问题:
在 0.1 mol·L-1的 Na2B 溶液中,下列粒子浓度关系式正确的是________。
A.c(B2-)+c(HB-)=0.1 mol·L-1
B.c(B2-)+c(HB-)+c(H2B)=0.1 mol·L-1
C.c(OH-)=c(H+)+c(HB-)
D.c(Na+)+c(H+)=c(OH-)+c(HB-)
常温下,用0.01mol·L-1NaOH溶液滴定20.00mL0.01mol·L-1CH3COOH溶液,所得滴定曲线如右图。下列说法正确的是
| A.a点对应溶液的pH=2 |
| B.b点对应的溶液中:c(OH-)+c(CH3COO-)=c(Na+)+c(H+) |
| C.c点表示NaOH溶液与CH3COOH溶液恰好完全反应 |
| D.d点对应的溶液中,水的电离程度小于同温下纯水的电离程度 |
下列关于pH变化的判断正确的是
| A.温度升高,Na2CO3溶液pH减小 |
| B.氢氧化钠溶液久置于空气中,溶液pH变大 |
| C.新制氯水经光照一段时间后,溶液pH减小 |
| D.温度升高,纯水pH增大 |
将纯水加热至较高温度,下列叙述正确的是
| A.水的离子积变大、pH变小、呈酸性 |
| B.水的离了积不变、pH不变、呈中性 |
| C.水的离子积变小、pH变大、呈碱性 |
| D.水的离子积变大、pH变小、呈中性 |
试题篮
()