如图表示水中c(H+)和c(OH﹣)的关系,下列判断错误的是
| A.两条曲线间任意点均有c(H+)×c(OH﹣)=KW |
| B.XZ线上任意点均有pH=7 |
| C.图中T1<T2 |
| D.M区域内任意点均有c(H+)<c(OH﹣) |
(14分)
Ⅰ.为了除去KCl溶液中少量的Mg2+、SO42-,可选用Ba(OH)2、HCl和K2CO3三种试剂,按如下步骤操作:
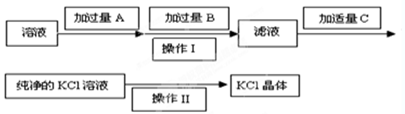
(1)上述试剂中, B是 ,
(2)操作Ⅱ的名称是 。
(3)加过量A时发生有关反应的离子方程式为 、 。
Ⅱ.一份溶液中可能含有K+、Al3+、H+、NH4+、Cl-、Br-、I-、ClO―、AlO2― 等离子中的若干种。为了确定溶液的组成,进行了如下操作:
(1)往该溶液中逐滴加入NaOH溶液并适当加热,产生沉淀和气体的物质的量(n)与加入NaOH溶液的体积关系如图所示;
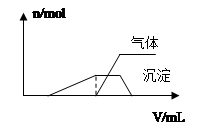
则该溶液中一定存在的离子是 ,
(2)经检测后,该溶液中含有大量的Cl-、Br-、I-,若向1L该混合溶液中通入一定量的氯气,则溶液中Cl-、Br-、I-与通入氯气的体积(标况下)关系如图所示,回答下列问题:
| Cl2的体积(标况下) |
2.8L |
5.6L |
11.2L |
| n(Cl- ) |
1.25mol |
1.5 mol |
2 mol |
| n(Br- ) |
1.5 mol |
1.4mol |
0.9 mol |
| n(I- ) |
a mol |
0 |
0 |
① 则a为
② 原溶液中Cl-、Br-、I-的物质的量浓度之比为
下列说法正确的是
| A.向50 mL 1 mol·L-1的盐酸中加入烧碱,水的KW不变 |
| B.NH4Cl和NH3·H2O混合液中,二者对对方的平衡都起了抑制作用 |
| C.有两种弱酸HX和HY且酸性HX>HY,则体积和浓度相同的NaX和NaY溶液中有c(Y-)>c(X-)>c(OH-)>c(H+) |
D.常温下0.1mol·L-1的HA溶液中 ,则0.01 mol·L-1HA溶液中c(H+)=1×10-4mol·L-1 ,则0.01 mol·L-1HA溶液中c(H+)=1×10-4mol·L-1 |
(16分)中学化学实验,淡黄色的pH试纸常用于测定溶液的酸碱性。在 25 ℃,若溶液的pH=7,试纸不变色;若pH<7,试纸变红色;若pH>7,试纸变蓝色。而要精确测定溶液的pH,需用pH计。pH计主要通过测定溶液中H+浓度来测定溶液的pH。
(1)已知水中存在如下平衡H2O  H++OH-ΔH>0。现欲使平衡向右移动,且所得溶液呈中性,选择的方法是 (填字母)。
H++OH-ΔH>0。现欲使平衡向右移动,且所得溶液呈中性,选择的方法是 (填字母)。
| A.向水中加入NaHSO4溶液 |
| B.向水中加入Cu(OH)2固体 |
| C.加热水至100 ℃[其中c(H+)=1×10-6 mol·L-1] |
| D.在水中加入H2SO4溶液 |
(2)现欲测定100 ℃沸水的pH及酸碱性,若用pH试纸测定,则试纸显 色,若用pH计测定,则pH 7 (填“>”“<”或“=”),溶液呈 性(填“酸”“碱”或“中”)。
(3)某市对大气进行监测,发现该市首要污染物为可吸入颗粒物PM2.5(直径小于等于2.5 μm的悬浮颗粒物),其主要来源为燃煤、机动车尾气等。因此,对PM2.5、SO2、NOx等进行研究具有重要意义。若测得该试样所含水溶性无机离子的化学组分及其平均浓度如下表:
| 离子 |
K+ |
Na+ |
NH4+ |
SO42- |
NO3- |
Cl- |
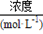 |
4×10-6 |
6×10-6 |
2×10-5 |
4×10-5 |
3×10-5 |
2×10-5 |
根据表中数据判断PM2.5的酸碱性为 ,试样的pH= 。
(4)①已知汽缸中生成NO的反应为N2(g)+O2(g) 2NO(g)ΔH>0,汽车启动后,汽缸温度越高,单位时间内NO排放量越大,原因是 。
2NO(g)ΔH>0,汽车启动后,汽缸温度越高,单位时间内NO排放量越大,原因是 。
②汽车燃油不完全燃烧时产生CO,有人设计下列反应除去CO:2CO(g)=2C(s)+O2(g),已知该反应的ΔH>0,简述该设想能否实现的依据 。
25℃时,将某一元碱MOH和盐酸溶液等体积混合(体积变化忽略不计),测得反应后溶液的pH如下表,则下列判断不正确的是
| A.实验甲所得溶液:c(Cl-)>c(M+)>c(H+)>c(MOH) |
B.将实验甲中所得溶液加水稀释后, 变小 变小 |
| C.a>0.10 |
D.MOH的电离平衡常数可以表示为Kb =  |
(14分)氮元素能形成多种多样的化合物。请回答:
(1)298 K时,在2L固定体积的密闭容器中,发生可逆反应:2NO2(g) N2O4(g) ΔH=-a kJ/mol (a>0) 。N2O4的物质的量浓度随时间变化如下图。达平衡时,N2O4的浓度为NO2的2倍,回答下列问题:
N2O4(g) ΔH=-a kJ/mol (a>0) 。N2O4的物质的量浓度随时间变化如下图。达平衡时,N2O4的浓度为NO2的2倍,回答下列问题:
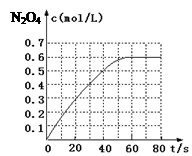
①298k时,该反应的平衡常数为 L·mol-1(精确到0.01);
②下列情况不能用来判断该反应是否处于平衡状态的是 ;
A.混合气体的密度保持不变;
B.混合气体的颜色不再变化;
C.混合气体的气体压强保持不变
③若反应在398K进行,某时刻测得n(NO2)="0.6" mol、n(N2O4)=1.2mol,则此时v(正) v(逆)(填 “>”、“<”或“=”)。
(2)常温条件下,向100 mL 0.1mol·L-1NH4HSO4溶液中滴加0.1 mol·L-1NaOH溶液,得到的溶液pH与NaOH溶液体积的关系曲线如下图所示。试分析图中a、b、c、d、e五个点(该条件下硫酸第二步电离是完全的)。

①a点溶液的pH_________1(填“>”“<”或“=”);
②b点溶液中发生水解反应的离子是____________;
③c点溶液中各离子浓度由大到小的排列顺序为 ;
④d、e点对应溶液中,水电离程度大小关系是d e(填“>”、“<”或“=”)。
(1)室温下pH=9的NaOH溶液和pH=9的CH3COONa溶液,设由水电离产生的OH-的物质的量浓度分别为A和B,则A和B的关系为 。
(2)在纯碱溶液中滴入酚酞,溶液变红色,若在该溶液中再滴入过量的BaCl2溶液,所观察到的现象是 ,其原因是 。
(3)对于盐AmBn的溶液:
①若为强酸弱碱盐,其水解的离子方程式是 ;
②若为弱酸强碱盐,其水解的离子方程式是 。
(4)已知KSP (Ag2CrO4)=1.12×10-12,将等体积的4×10-3mo1·L-1的AgNO3和4×10-3mo1·L–1K2CrO4混合,________产生Ag2CrO4沉淀(填“能”或“不能”)。
某化学研究性学习小组对溶液作如下的归纳总结(均在常温下)。其中正确的是
①pH=3的强酸溶液1 mL,加水稀释至100 mL后,溶液pH降低2个单位
②1 L 0.50 mol·L-1 NH4Cl 溶液与2 L 0.25 mol·L-1 NH4Cl 溶液含NH4+物质的量前者大
③在某钠盐溶液中含有等物质的量的Cl-、I-、AlO2-、CO32-、NO3-、SiO32-中若干种,当加入过量的盐酸产生气泡,溶液颜色变深,则原溶液中一定有CO32-
④pH=4、浓度均为0.1 mol·L-1 的CH3COOH、CH3COONa混合溶液中:c(CH3COO-)+c(CH3COOH)=2c(Na +)
| A.①② | B.②③ | C.①③ | D.②④ |
下列图象表达正确的是
| A.图①表示25℃时, 用0.1mol·L-1盐酸滴定20mL 0.1mol·L-1NaOH溶液 |
| B.图②表示常温下,两份足量、等浓度的盐酸与等量锌粉反应时,其中一份滴加了少量硫酸铜溶液 |
| C.图③表示向CaCl2和盐酸的混合溶液中滴加Na2CO3溶液 |
| D.图④表示向醋酸溶液中滴入氨水 |
(每小题2分,共14分)某烧碱样品中含有少量不与酸作用的可溶性杂质,为了测定其纯度,进行以下滴定操作:
| A.在250mL的容量瓶中定容成250mL烧碱溶液; |
| B.用移液管移取25mL烧碱溶液于锥形瓶中并滴加几滴甲基橙指示剂; |
| C.在天平上准确称取烧碱样品Wg,在烧杯中加蒸馏水溶解; |
| D.将物质的量浓度为Mmol/L的标准H2SO4溶液装入酸式滴定管,调整液面,记下开始时的刻度数为V1mL; |
E.在锥形瓶下垫一张白纸,滴定到终点,记录终点时消耗酸的体积为V2mL。
回答下列问题:
(1)正确的操作步骤的顺序是(用字母填写)
________→________→________→____D____→________;
(2)滴定管读数应注意 ___________________。
(3)操作E中在锥形瓶下垫一张白纸的作用是 _________________。
(4)操作D中液面应调整到 ,尖嘴部分应 。
(5)滴定终点时锥形瓶内溶液的pH约为 ,终点时溶液颜色的变化是 。
(6)若酸式滴定管没有用标准H2SO溶液润洗,会对测定结果有何影响? (填“偏高”、“偏低”或“无影响”)(其他操作均正确)。
(7)该烧碱样品的纯度计算式是 。
强酸与强碱的稀溶液发生中和反应的热效应为H+(aq)+OH-(aq)=H2O(l);△H= -57.3kJ·mol-1。已知:醋酸电离要吸热。稀醋酸、浓硫酸、稀硝酸分别与0.1mol·L-1的NaOH溶液恰好完全反应放出的热量关系如图所示。则下列描述正确的是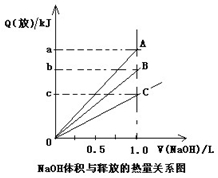
| A.A表示稀硝酸与NaOH溶液反应 |
| B.B表示稀醋酸与NaOH溶液反应 |
| C.b=5.73 |
| D.C表示浓硫酸与NaOH溶液反应 |
(一)已知水的电离平衡曲线如图所示,试回答下列问题:

(1)E对应的温度下,将pH=9的NaOH溶液与pH=4的H2SO4溶液混合,若所得混合溶液的pH=7,则NaOH溶液与H2SO4溶液的体积比为_______ _
(2)B对应温度下,将pH=11的苛性钠溶液V1 L与pH=1的稀硫酸V2 L混合(设混合后溶液的体积与原两溶液体积之和),所得混合溶液的pH=2,则V1∶V2=___________________
(二)膜技术原理在化工生产中有着广泛的应用。有人设想利用电化学原理制备少量硫酸和绿色硝化剂N2O5,装置图如下。
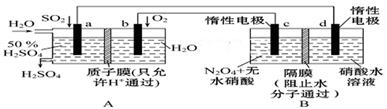
(1)A装置是________________,B装置是____________(填“原电池”或“电解池”)。
(2)N2O5在电解池的______________(填“c极”或“d极”)区生成,其电极反应式为__________________
(3)A装置中通入SO2一极的电极反应式为
(4)若A装置中通入SO2的速率为2.24 L·min-1(标准状况),为稳定持续生产,硫酸溶液的浓度应维持不变,则左侧水的流入速率应为_______________mL·min-1。
(1)常温下某溶液中由水电离出的离子浓度符合c(H+)·c(OH-)=1×10-20的溶液,其pH为____________,此时水的电离受到______________。
(2)已知:2NO2(g)===N2O4(g)ΔH=-57.20 kJ·mol-1。一定温度下,在密闭容器中反应2NO2(g)===N2O4(g)达到平衡。其他条件不变时,下列措施能提高NO2转化率的是__________(填字母)。
A.减小NO2的浓度 B.降低温度
C.增加NO2的浓度 D.升高温度
(3)在某温度下,H2O的离子积常数为1×10-13 mol2·L-2,则该温度下:
①0.01 mol·L-1NaOH溶液的pH=_____________;
②100 mL 0.1 mol·L-1H2SO4溶液与100 mL 0.4 mol·L-1的KOH溶液混合后,pH=___________。
(4)已知一溶液有4种离子:X+、Y-、H+、OH-,下列分析结果肯定错误的是______________。
A.c(Y-)>c(X+)>c(H+)>c(OH-) B.c(X+)>c(Y-)>c(OH-)>c(H+)
C.c(H+)>c(Y-)>c(X+)>c(OH-) D.c(OH-)>c(X+)>c(H+)>c(Y-)
(5)在25 ℃下,将a mol·L-1的氨水与0.01 mol·L-1的盐酸等体积混合,反应时溶液中c(NH4+)=c(Cl-)。则溶液显___________(填“酸”“碱”或“中”)性;用含a的代数式表示NH3·H2O的电离常数Kb=________________。
(6)水溶液中的行为是中学化学的重要内容。已知下列物质的电离常数值(25 ℃):
HClO:Ka=3×10-8 HCN:Ka=4.9×10-10 H2CO3:Ka1=4.3×10-7 Ka2=5.6×10-11
84消毒液中通入少量的CO2,该反应的化学方程式为_____________________。
浓度均为0.10mol/L、体积均为V0的MOH和ROH溶液,分别加水稀释至体积V,pH随 的变化如图所示,下列叙述错误的是
的变化如图所示,下列叙述错误的是
| A.MOH的碱性强于ROH的碱性 |
| B.ROH的电离程度:b点大于a点 |
| C.若两溶液无限稀释,则它们的c(OH-)相等 |
D.当 =2时,若两溶液同时升高温度,则 =2时,若两溶液同时升高温度,则  增大 增大 |
试题篮
()