(5分)欲测定某NaOH溶液的物质的量浓度,可用0.1000mol·L-1HCl标准溶液进行中和滴定(用酚酞作指示剂)。
请回答下列问题:
(1)若甲学生在实验过程中,记录滴定前滴定管内液面读数为1.10mL,滴定后液面如图,则此时消耗标准溶液的体积为 ;
(2)乙学生做了三组平行实验,数据记录如下:
| 实验序号 |
待测NaOH溶液的体积/mL |
0.1000mol·L-1HCl溶液的体积/mL |
|
| 滴定前刻度 |
滴定后刻度 |
||
| 1 |
25.00 |
0.00 |
26.11 |
| 2 |
25.00 |
1.56 |
31.30 |
| 3 |
25.00 |
0.22 |
26.31 |
选取上述合理数据,计算出待测NaOH溶液的物质的量浓度为 (小数点后保留四位);
(3)下列哪些操作会使测定结果偏高 (填序号)。
A.锥形瓶用蒸馏水洗净后再用待测液润洗
B.酸式滴定管用蒸馏水洗净后再用标准液润洗
C.滴定前酸式滴定管尖端气泡未排除,滴定后气泡消失
D.滴定前读数正确,滴定后俯视滴定管读数
常温下,0.1mol·L-1某一元酸(HA)溶液中c(OH-)/c(H+)=1×10-8,相同物质的量浓度的某一元碱(BOH)溶液中c(OH-)/c(H+)=1×1012,下列叙述正确的是
A.HA的pH=3;BOH的pH=13
B.pH=a的HA溶液,稀释10倍,其pH=a+1
C.等体积的HA和BOH恰好完全反应,溶液的pH=7
D.相同体积相同pH的HA和盐酸分别与足量Zn反应,生成氢气的物质的量相同
用某浓度的HCl溶液滴定某浓度的NaOH溶液25.00 mL,滴定曲线如图所示。则HCl溶液与NaOH溶液的物质的量浓度可能是(单位:mol·L-1)
| |
A |
B |
C |
D |
| HCl |
0.12 |
0.10 |
0.10 |
0.08 |
| NaOH |
0.10 |
0.12 |
0.08 |
0.10 |
下列说法正确的是
| A.25℃时,pH=3的CH3COOH溶液加水稀释10倍后,pH=4 |
| B.25℃时,pH=11的NaOH溶液加水稀释100倍后,pH=9 |
| C.25℃时,pH=3的CH3COOH溶液与pH=11的NaOH溶液等体积混合后,pH=7 |
| D.90℃时,纯水的pH=6.2,所以加热可以使水呈酸性 |
在25mL氢氧化钠溶液中逐滴加入0.2mol/L醋酸溶液,滴定曲线如右图所示,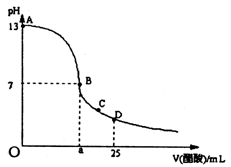
(1)写出氢氧化钠溶液与醋酸溶液反应的离子方程式 。
(2)该氢氧化钠溶液的物质的量浓度为 mol·L—1。
(3)在B点,a 12.5ml(填“大于”、“小于”或“等于”,下同)。若由体积相等的氢氧化钠和醋酸混合而且恰好呈中性,则混合前c(NaOH)____ c(CH3COOH),混合前酸中 c(H+)和碱中c(OH-)的关系:c(H+)________ c(OH-)。
(4)在D点溶液中离子浓度大小关系为 。
在常温下,将pH=11的某碱溶液和pH=3的某酸溶液等体积混合后,下列说法不正确的是
| A.若所得溶液呈中性,则生成的盐可能为强酸强碱盐 |
| B.若所得溶液呈碱性,则一定是强碱与弱酸溶液反应 |
| C.若所得溶液呈酸性,则可能是弱酸与强碱溶液反应 |
| D.若所得溶液的pH=9,则水电离产生的c(OH-)可能为10-9mol/L |
(8分)硫酸是强酸,中学阶段将硫酸在水溶液中看作完全电离。但事实是,硫酸在水中的第一步电离是完全的,第二步电离并不完全,其电离情况为:H2SO4=H++HSO4-,HSO4- H++SO42-。请回答下列有关问题:
H++SO42-。请回答下列有关问题:
(1)K2SO4溶液呈_______(填“弱酸性”、“中性”或“弱碱性”),其理由是 (用离子方程式表示)。
(2)NaHSO4溶液与NaHCO3溶液反应的离子方程式为 。
(3)若25℃时,0.10 mol/L的NaHSO4溶液中c(SO42-)="0.03" mol/L,则HSO4-的电离常数Ka= (保留两位有效数字)。0.10 mol/L的H2SO4溶液中c(H+) 0.13mol/L (填“>”、“=”或“<”)。
室温时,盐酸和硫酸的混合溶液20mL,向混合物中逐滴加入0.05mol·L-1Ba(OH)2溶液时,生成的BaSO4和pH的变化如图所示(不考虑溶液混合时体积的变化)。下列说法正确的是
| A.图中A点对应溶液的pH:a=1 |
| B.生成沉淀的最大质量m=2.33g |
| C.原混合液中c(HCl)=0.2mol·L-1 |
| D.当V[Ba(OH)2(aq)]=30mL时,有关离子浓度大小:c(Cl-)>c(Ba2+)>c(H+) |
下列各表述与示意图一致的是
| A.图①表示25℃时,用0.1 mol·L-1盐酸滴定10 mL 0.05 mol·L-1 Ba(OH)2溶液,溶液的pH随加入酸体积的变化 |
| B.图②表示充有NO2的恒温密闭容器在t时刻增大压强时,c(NO2)随时间的变化 |
C.图③中曲线表示反应N2 (g) +3 H2(g) 2NH3(g) ΔH < 0 ,正、逆反应的平衡常数K随温度的变化 2NH3(g) ΔH < 0 ,正、逆反应的平衡常数K随温度的变化 |
D.图④中a、b曲线分别表示反应2SO2(g) + O2(g) 2SO3(g) ΔH<0使用(a)和未使用(b)催化剂时,反应过程中的能量变化 2SO3(g) ΔH<0使用(a)和未使用(b)催化剂时,反应过程中的能量变化 |
下列说法正确的是
| A.常温pH=11的烧碱溶液与pH=3的稀醋酸等体积混合后,滴入石蕊试液呈红色 |
| B.T ℃时,pH=6的纯水中,含10–8 NA个OH-(NA表示阿伏加德罗常数) |
| C.将NaAlO2、FeCl3、Al2(SO4)3的水溶液分别在蒸发皿中加热、蒸干并灼烧,都能得原溶质 |
| D.常温在由水电离的c(H+)=1×10–13mol/L的溶液里,能大量存在NH4+、Fe2+、NO3- |
下表是不同温度下水的离子积数据:
| 温度(℃) |
25 |
t1 |
t2 |
| 水离子积常数 |
1×10-14 |
α |
1×10-12 |
试回答下列问题:
(1)若25<t1<t2,则α (填“>”、“>”或“=”)1×10-14,作出此判断的理由是 。
(2)在t1时,测得纯水中的c(H+)=2.4×10-7mol/L,则c(OH-)为 。该温度下,测得某H2SO4溶液中c(SO42-)=5×10-6 mol·L-1,该溶液中c(OH-)= mol·L-1。
(3)t2℃下:①0.01 mol·L-1的氢氧化钠溶液的pH= 。
②若10体积的某强酸溶液与1体积的某强碱溶液混合后溶液呈中性,则混合之前,该强酸的pH值pH1与强碱的pH值pH2之间应满足的关系是 。
现代传感信息技术在化学实验中有广泛的应用。

Ⅰ.某小组用传感技术测定喷泉实验中的压强变化来认识喷泉实验的原理(图1)。
(1)制取氨气。烧瓶中制取NH3的化学方程式为 ,检验三颈瓶集满NH3的方法是 。
(2)关闭a,将吸有2mL水的胶头滴管塞紧颈口c,打开b,完成喷泉实验,电脑绘制三颈瓶内气压变化曲线(图2)。图2中 点时喷泉最剧烈。
Ⅱ.测定NH3•H2O的浓度及电离平衡常数Kb
(3)从三颈瓶中用 (填仪器名称)量取25.00mL氨水至锥形瓶中,用0.0500 mol•L-1HCl滴定。用pH计采集数据、电脑绘制滴定曲线如下图。

(4)据图,计算氨水的浓度为 mol•L-1;写出NH3•H2O电离平衡常数Kb的表达式,Kb= ,当pH=11.0时计算Kb的近似值,Kb≈ 。
(5)关于该滴定实验的说法中,正确的是 。
| A.锥形瓶中有少量蒸馏水不影响测定结果 |
| B.未滴加酸碱指示剂,实验结果不科学 |
| C.酸式滴定管未用盐酸润洗会导致测得氨水的浓度偏高 |
| D.滴定终点时俯视读数会导致测得氨水的浓度偏高 |
25℃时,用0.100 mol/L NaOH 溶液分别滴定20.00 mL 0.100 mol/L的盐酸和20.00 mL 0.100 mol/L醋酸(忽略温度变化)。下列说法正确的是
| A.滴定前,盐酸和醋酸溶液中:c(Cl‾)<c(CH3COO—) |
B.分别加入10.00 mL NaOH溶液时,测得醋酸反应后所得溶液pH=6,则溶液中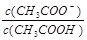 >1 >1 |
| C.当两种溶液的pH均等于7时,两种酸所消耗NaOH溶液体积不相等,醋酸消耗的NaOH溶液体积多 |
| D.加入20.00 mL NaOH溶液时,所得两种溶液中:c(Cl‾)<c(CH3COO—) |
已知水在25℃和95℃时,其电离平衡曲线如下图所示:
(1)25℃时水的电离平衡曲线应为 (选填“A”或“B”)
(2)25℃时,将PH=9的NaOH溶液与PH=4的盐酸溶液混合,若所得混合溶液的PH=7,则NaOH溶液与盐酸溶液的体积比为 。
(3)95℃时,若100体积PH=a的某强酸溶液与1体积ph=b的某强碱溶液混合后溶液呈中 性,则混合前,a与b之间应满足的关系是
试题篮
()