草酸是二元中强酸,草酸氢钠溶液显酸性。常温下,向10 mL 0.01 mol/L NaHC2O4溶液中滴加0.01 mol/L NaOH溶液,随着NaOH溶液体积的增加,溶液中离子浓度关系正确的是
| A.V(NaOH)=0时,c(H+)=1×10-2 mol/L() |
B.V(NaOH)<10 mL时,不可能存在c(Na+)= |
| C.V(NaOH)=10 mL时,c(H+)=1×10-7 mol/L |
| D.V(NaOH)>10 mL时,c(Na+)> c(C2O42-)> c(HC2O4-) |
(共5分)今有a·盐酸、b·硫酸、 c·醋酸三种酸:(以下均用字母序号回答)
(1)在同体积,同pH的三种酸中,分别加入足量的碳酸钠粉末,在相同条件下产生CO2的体积由大到小的顺序是______________________。
(2)在同体积、同浓度的三种酸中,分别加入足量的碳酸钠粉末,在相同条件下产生CO2的体积由大到小的顺序是_______________________。
(3)当PH相同、体积也相同时,分别与过量同一浓度的NaOH溶液反应,消耗碱的体积由大到小的顺序为 。
(4)当PH相同时, 分别与等物质的量NaOH溶液反应, 消耗酸的体积由大到小的顺序为 。
(5)将PH相同的三种酸溶液均加水稀释至相同的PH时,则加水的体积由大到小的顺序为 。
在不同温度下,水达到电离平衡时c(H+)与c(OH—)的关系如图4所示,下列说法中正确的是
| A.100℃时,pH=12的NaOH溶液和pH=2的H2SO4溶液恰好中和,所得溶液的pH等于7 |
| B.25℃时,0.2 mol/L Ba(OH)2溶液和0.2 mol/L HCl溶液等体积混合,所得溶液的pH等于7 |
| C.25℃时, 0.2 mol/L NaOH溶液与0.2 mol/L乙酸溶液恰好中和,所得溶液的pH等于7 |
| D.25℃时,pH=12的氨水和pH=2的H2SO4溶液等体积混合,所得溶液的pH大于7 |
下列叙述正确的是
①pH=5的CH3COOH溶液和pH=5的NH4Cl溶液中,c(H+)相等
②Na2CO3溶液加水稀释后,恢复至原温度,pH和Kw均减小
③某醋酸溶液的pH=a,将此溶液稀释1倍后,溶液的pH=b,则a>b
④在滴有酚酞溶液的氨水中,加入NH4Cl至溶液恰好无色,则此时溶液的pH<7
⑤1.0×10-3 mol/L盐酸的pH=3.0; 1.0×10-8 mol/L盐酸的pH=8.0
⑥若1 mL pH=1的盐酸与100 mL NaOH溶液混合后,溶液的pH=7,则NaOH溶液
的pH=11
⑦10mL pH=12的氢氧化钠溶液中加入pH=2的HA至pH刚好等于7,所得溶液体积
V(总)≥20mL
| A.①⑥ | B.②⑦ | C.③④ | D.⑤⑥ |
把0.02mol/LCH3COOH溶液和0.01mol/LNaOH溶液以等体积混和,则混合液中微粒浓度关系正确的为 ( )
| A.c (CH3COO-)="c" (Na+) | B.c (OH-)>c (H+) |
| C.c (CH3COOH)>c (CH3COO-) | D.c (CH3COOH)+c (CH3COO-)=0.01mol/L |
常温下,用0.1000 mol·L-1 NaOH溶液滴定20.00 mL 0.1000 mol·L-1 CH3COOH溶液所得滴定曲线如下图。下列说法正确的是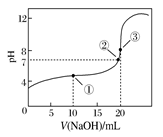
| A.点①所示溶液中:c(CH3COO-)+c(OH-)=c(CH3COOH)+c(H+) |
| B.点②所示溶液中:c(Na+)=c(CH3COOH)+c(CH3COO-) |
| C.滴定过程中可能出现:c(CH3COOH)>c(CH3COO-)>c(H+)>c(Na+)>c(OH-) |
| D.点③所示溶液中:c(Na+)>c(OH-)>c(CH3COO-)>c(H+) |
下列说法正确的是
| A.Na2CO3溶液中c(Na+)与c(CO32-)之比为2:1 |
| B.pH=2与pH=1的硝酸中c(H+)之比为1:10 |
| C.0.2 mol•L-1与0.1mol/L醋酸中c(H+)之比为2:1 |
| D.相同体积的0.1 mol•L-1盐酸和0.1mol/L醋酸分别与足量镁条反应,放出H2的体积比大于1:1 |
直接排放含SO2的烟气会形成酸雨,危害环境。利用钠碱循环法可脱除烟气中的SO2.。
(1) 在钠碱循环法中,Na2SO3溶液作为吸收液,可由NaOH溶液吸收SO2制得,该反应的离子方程式是 
①由上表判断NaHSO3溶液显 性,用化学平衡原理解释:
②当吸收液呈中性时,溶液中离子浓度关系正确的是(选填字母):
a.c(Na+) = 2c(SO32-)+c(HSO3-)
b.c(Na+)>c(HSO3-)>c(SO32-)>c(H+) = c(OH-)
c.c(Na+)+c(H+)=c(SO32-)+c(HSO3-)+c(OH-)
MOH强碱溶液和等体积等浓度的HA弱酸溶液混合后,溶液中有关离子的浓度应满足的关系是
| A.c(M+)>c(OH-)>c(A-)>c(H+) | B.c(M+)> c(A-) > c(H+)> c(OH-) |
| C.c(M+)> c(A-) > c(OH-) >c(H+) | D.c(M+)> c(H+) >c(A-)> c(OH-) |
室温时,将浓度和体积分别为C1、V1的NaOH溶液和C2、V2的CH3COOH溶液相混合,下列关于该混合溶液的叙述错误的是
| A.若PH>7,则一定是C1V1=C2V2 |
| B.在任何情况下都是C(Na+)+C(H+)=C(CH3COO-) +C(OH-) |
| C.当PH=7时,若V1=V2,一定是C2>C1 |
| D.若V1=V2,C1=C2,则C(CH3COO-) +C(CH3COOH)=C(Na+) |
氢氟酸是一种弱酸,可用来刻蚀玻璃。已知25℃时
①HF(aq)+OH—(aq)=F—(aq)+H2O(l) △H=−67.7KJ·mol—1
②H+(aq)+OH—(aq)=H2O(l) △H=−57.3KJ·mol—1
在20mL0.1·molL—1氢氟酸中加入VmL0.1mol·L—1NaOH溶液,下列有关说法正确的是
| A.氢氟酸的电离方程式及热效应可表示为:HF(aq)=H+(aq) +F−(aq)△H=+10.4KJ·mol—1 |
| B.当V=20时,溶液中:c(OH—)=c(HF) +c(H+) |
| C.当V=20时,溶液中:c(F—)<c(Na+)=0.1mol·L—1 |
| D.当V>20时,溶液中一定存在:c(Na+)>c(F—)>c(OH—)>c(H+) |
下列叙述正确的是
| A.某醋酸溶液的pH=a,将此溶液稀释10倍后,溶液的pH=b,则a>b |
| B.常温下,某溶液中由水电离的c(OH-) = 1.0×10-13,则此溶液一定呈酸性 |
| C.25℃时,将pH=4的盐酸稀释1000倍后,溶液的pH=7 |
| D.25℃时,pH=13的强碱溶液与pH=2的强酸溶液混合,若所得混合液的pH=7,则强碱与强酸的体积比是1:10 |
草酸晶体的组成可用H2C2O4·xH2O表示,为了测定x值,进行如下实验:
称取Wg草酸晶体,配成100.00mL无色水溶液。量取25.00mL所配制的草酸溶液置于锥形瓶内,加入适量稀H2SO4后,用浓度为amol·L-1的KMnO4溶液滴定。试回答:
(1)滴定时所发生反应的化学方程式为
(2)草酸是二元弱酸,则草酸的电离方程式为 请从“电离平衡”的角度解释:为什么草酸的第二步电离比第一步难
(3)实验中不需要的仪器有(填序号)___________,还缺少的仪器有(填名称)______________________________。
a.托盘天平(带砝码,镊子) b.酸式滴定管 c.碱式滴定管 d.100mL容量瓶 e.烧杯
f.漏斗 g.锥形瓶 h.玻璃棒 i.药匙 j.烧瓶
图I表示100mL量筒中液面的位置,A与B,B与C刻度间相差10mL,如果刻度A为30,量筒中液体的体积是___________mL。图II表示25mL滴定管中液面的位置,如果液面处的读数是a,则滴定管中液体的体积(填代号)_____________。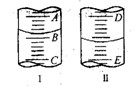
| A.是amL | B.是(25-a)mL | C.一定大于amL | D.一定大于(25-a)mL |
(4)实验中,标准液KMnO4溶液应装在_______式滴定管中。若在接近滴定终点时,用少量蒸馏水将锥形瓶内壁冲洗一下,再继续滴定至终点,则所测得的x值会_____(偏大、偏小、无影响)达到滴定终点,溶液由 色变为 色;
(5)在滴定过程中若用amol·L-1的KMnO4溶液VmL,则所配制的草酸溶液的物质的量浓度为_____________mol·L-1;
(6)若测得x=2,称取某二水合草酸晶体0.1200 g,加适量水完全溶解,然后用0.02000 mol·L-1的酸性KMnO4溶液滴定至终点(杂质不参与反应),滴定前后滴定管中的液面读数如图所示,则该草酸晶体样品中二水合草酸的质量分数为 。
试题篮
()