下列溶液或浊液中,关于离子浓度的说法正确的是
| A.一定浓度的氨水加水稀释的过程中,c(NH4+)/ c(NH3·H2O)的比值减小 |
| B.浓度均为0.1 mol·L-1的Na2CO3、NaHCO3混合溶液中:c(CO32-)< c(HCO3-),且3c(Na+)=2[c(CO32-)+c(HCO3-+ c(H2CO3)] |
| C.0.2 mol·L-1的醋酸(CH3COOH)溶液与0.1 mol·L-1 NaOH溶液等体积混合后:c(CH3COO-) + 2c(OH-)=c(CH3COOH) + 2c(H+) |
| D.常温下,已知:Ksp(AgCl)=1.8×10-10,Ksp(Ag2Cr2O4)=2.0×10-12,则Ag2CrO4悬浊液中的c(Ag+)一定小于AgCl悬浊液中的c(Ag+) |
25℃时,浓度均为0.1mol·L-1的HA溶液和BOH溶液,pH分别是1和12。下列说法正确的是
| A.在0.1 mol·L-1BA溶液中,c(A-)+c(H+)=c(BOH)+c(OH-) |
| B.若将0.1mol·L-1BOH溶液稀释至0.001 mol·L-1则溶液的pH=10 |
| C.若将一定量的上述两溶液混合后pH=7,则混合液中:c(A-)>c(B+) |
| D.若将上述两溶液按体积比l:2混合,则混合液中:c(B+)>c(A-)>c(OH-)>c(H+) |
已知温度T时水的离子积常数为Kw,该温度下,将浓度为a mol/L的一元酸HA与bmol/L的一元碱BOH等体积混合,可判断溶液呈中性的依据是
| A.a = b |
| B.混合溶液中,c(H+) + c(B+) = c(OH-) + c(A-) |
C.混合溶液中,c(H+) =  |
| D.混合溶液的pH = 7 |
常温时,纯水中由水电离的c(H+)=a,pH=1的盐酸中由水电离的c(H+)=b,0.2 mol/L的盐酸与0.1 mol/L的氢氧化钠溶液等体积混合后,由水电离的c(H+)=c,则a、b、c的关系正确的是
| A.a>b=c | B.c>b>a | C.a>c>b | D.b>c>a |
在不同温度下,水达到电离平衡时c(H+)与c(OH-)的关系如图所示,下列说法中正确的是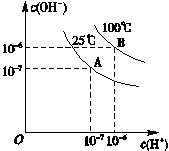
| A.100 ℃时,pH=12的NaOH溶液和pH=2的H2SO4溶液等体积混合时恰好中和,所得溶液的pH等于7 |
| B.25 ℃时,0.2 mol/L Ba(OH)2溶液和0.2 mol/L HCl溶液等体积混合,所得溶液的pH等于7 |
| C.25 ℃时,0.2 mol/L NaOH溶液与0.2 mol/L醋酸等体积混合后恰好中和,所得溶液pH等于7 |
| D.25 ℃时,pH=12的氨水和pH=2的H2SO4溶液等体积混合,所得溶液的pH大于7 |
25 ℃时,在1.0 L浓度均为0.01 mol·L-1的某一元酸HA与其钠盐组成的混合溶液中,测得c(Na+)>c(A-),则下列描述中不正确的是( )
A.该溶液的pH<7
B.HA的酸性很弱,A-的水解程度较大
C.c(A-)+c(HA)=0.02 mol·L-1
D.n(A-)+n(OH-)=0.01 mol+n(H+)
一定温度下,向0.1 mol·L-1 CH3COOH溶液中加少量水,下列有关说法错误的是( )
| A.溶液中所有离子的浓度都减小 | B.CH3COOH的电离程度变大 |
| C.水的电离程度变大 | D.溶液的pH增大 |
pH=2的A、B两种酸溶液各1mL,分别加水稀释到1L(其pH与溶液体积V的关系如图 所示),下列说法正确的是( )
①a=5时,A是强酸,B是弱酸; ②若A、B都是弱酸,则5>a>2;
③稀释后,A酸溶液的酸性比B酸溶液强; ④A、B两种酸溶液的物质的量浓度一定相等.

A.①② B.③④ C.①③ D.②④
常温时,纯水中由水电离的C(H+)=a;PH=1的盐酸中由水电离的C(H+)=b;0.2mol/L的盐酸与0.1mol/L的氢氧化钠溶液等体积混合后(恢复至常温,不考虑体积变化),由水电离的C(H+)=c,则a、b、c的关系正确的是( )
| A.a>b="c" | B.b>c>a | C.c>b>a | D.a>c>b |
下列溶液显酸性的是( )
①pH<7的溶液 ②c(H+)=c(OH-)的溶液 ③c(H+)=1×10-6 mol·L-1的溶液 ④c(H+)>c(OH-)的溶液 ⑤0.1 mol·L-1的NH4Cl溶液 ⑥NaHCO3溶液
| A.①③④⑤⑥ | B.②④⑤⑥ | C.⑤⑥ | D.④⑤ |
下列说法正确的是
| A.某盐的水溶液呈酸性,该盐一定是强酸弱碱盐 |
| B.弱电解质溶液稀释后,溶液中各种离子浓度一定都减小 |
| C.水的离子积常数KW随着温度的升高而增大,说明水的电离是吸热反应 |
| D.中和相同体积、相同pH的盐酸和醋酸溶液所需NaOH的物质的量相同 |
下列操作中,能使水的电离平衡向右移动,而且所得溶液显酸性的是
| A.在水中加入少量氯化钠,并加热到100 ℃ |
| B.在水中滴入稀硫酸 |
| C.在水中加入小苏打 |
| D.在水中加入氯化铝固体 |
试题篮
()