25℃时,水的电离达到平衡:H2O H++OH- △H>0,下列叙述正确的是
H++OH- △H>0,下列叙述正确的是
| A.向水中加入稀氨水,平衡逆向移动,c(OH-)降低 |
| B.向水中加入少量固体硫酸氢钠,c(H+)增大,KW不变 |
| C.向水中加入少量固体CH3COONa,平衡逆向移动,c(H+)降低 |
| D.将水加热,KW增大,pH不变 |
化学中常借助曲线图来表示某种变化过程,如平衡移动过程、中和滴定过程、沉淀的生成和溶解、④固体物质的溶解度变化过程等,下列曲线图中从左到右依次表示上述过程中的( )

| A.①②③④ | B.②③①④ | C.④③②① | D.②①③④ |
将①H+、②NH4+、③NO3-、④K+、⑤CO32-、⑥OH-分别加入H2O中,基本上不影响水的电离平衡的是
| A.③④ | B.②③⑥ | C.①⑥ | D.②④ |
下列说法正确的是
| A.pH=11的氨水与pH=3的盐酸等体积混合:c(Cl-)=c(NH4+)>c(OH-)=c(H+) |
| B.0.2mol/L的CH3COOH溶液与0.1mol/L的NaOH溶液等体积混合:2c(Na+)=c(CH3COO-) |
| C.浓度均为0.10mol/L的氨水和氯化铵溶液等体积混合后:c(NH3·H2O)+c(NH4+)=0.1mol/L |
| D.pH=3的盐酸和pH=11的氢氧化钡等体积混合pH>7 |
下列溶液均处于 25℃,有关叙述正确的是
| A.AgCl 在同浓度的CaCl2 和NaCl溶液中的溶解度相同 |
| B.0.1 mol∙L-1的Na2S溶液中,c(OH-)=c(H+)+c(HS-)+c(H2S) |
| C.含有 NH4+、Cl-、H+、OH-的溶液中,其离子浓度一定是:c(Cl-)>c(NH4+)>c(H+)>c(OH-) |
| D.pH=4.5的番茄汁中 c(H+) 是 pH=6.5 的牛奶中 c(H+)的 100 倍 |
已知 pOH值指溶液的碱度,以溶液中氢氧根离子浓度来表示,pOH=-lgc(OH-)。则下列溶液,一定呈中性的是
| A.c(H+)=1×10-7mol∙L-1的溶液 | B.pH=pOH 的溶液 |
| C.pH=14-pOH的溶液 | D.pOH=0的溶液 |
将纯水加热至较高温度,下列叙述正确的是( )
| A.水的离子积变大,c(H+)变大,呈中性 |
| B.水的离子积不变,c(H+)不变,呈中性 |
| C.水的离子积变小,c(H+)变小,呈碱性 |
| D.水的离子积变大,c(H+)变大,呈酸性 |
室温下,某溶液由水电离出来的c(OH-)=10-13mol/L,则该溶液的溶质不可能是( )
| A.HCl | B.NaOH | C.H2SO4 | D.NH4NO3 |
某温度下,水的离子积Kw=1×10-13,则该温度下,pH=12的强碱溶液与pH=2的强酸溶液混合,所得混合溶液的pH=10,则强碱与强酸的体积比是
| A.11﹕1 | B.9﹕1 | C.1﹕11 | D.1﹕9 |
某温度下水的离子积常数为KW,该温度下,将a mol/L的一元酸HA与b mol/L一元碱BOH等体积混合,可判定该溶液呈中性的依据是
| A.a=b |
| B.混合溶液的pH=7 |
C.混合溶液中,c(H+)= 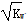 mol/L mol/L |
| D.混合溶液中,c(H+)+c(B+)=c(OH-)+c(A-) |
用0.1000mol·L-1标准NaOH溶液测定食醋中醋酸的含量,下列说法正确的是( )
| A.酸式滴定管、碱式滴定管及锥形瓶均需洗净后再润洗内壁2~3次 |
| B.应该选择酚酞作指示剂 |
| C.滴定过程中眼睛应始终注视滴定管内液面变化 |
| D.读取标准液的刻度时,滴定前平视,滴定后仰视,测定结果偏低 |
用标准的KOH溶液滴定未知浓度的盐酸,若测定结果偏低,其原因可能是( )
| A.配制标准溶液的固体KOH中混有NaOH杂质 |
| B.滴定终点读数时,仰视滴定管的刻度,其他操作正确 |
| C.盛装未知液的锥形瓶用蒸馏水洗过后再用未知液润洗 |
| D.滴定到终点读数时,发现滴定管尖嘴处悬挂一滴溶液 |
己知lg2="0.3" ,lg5 =" 0.7" ,某温度(t℃)时,测得0.0lmol/L的NaOH溶液的pH="11" 。在此温度下,将60mLpH=1的H2SO4溶液与40mL0.1mol/L的Ba(OH)2溶液混合(忽略溶液混合体积的变化),所得溶液的pH为( )
| A.12.3 | B.11.7 | C.11.3 | D.12.7 |
(原创) 25℃时,向V mL PH= a的稀硫酸中,滴加10V mL pH=b的NaOH溶液,所得溶液中2c( SO42— ) = c(Na+),则a+b的值是
| A.13 | B.14 | C.15 | D.不能确定 |
试题篮
()