常温下,用0.1 mol/L的NaOH溶液滴定10.0 mL0.1 mol/L的HA溶液,其滴定曲线如图所示,下列说法不正确的是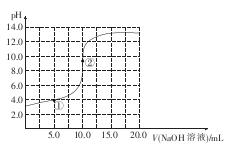
A.HA是弱酸
B.②处:c(H+)>c(OH-)
C.①处:c(Na+)<c(A-)
D.②处:c(Na+)=c(A-)+c(HA)
在一定体积pH = 12的Ba(OH)2溶液中,逐滴加入一定物质的量浓度的NaHSO4溶液,当溶液中的Ba2+恰好完全沉淀时,溶液pH = 11。若反应后溶液的体积等于Ba(OH)2溶液与NaHSO4溶液的体积之和,则Ba(OH)2溶液与NaHSO4溶液的体积比是
| A.1∶9 | B.1∶1 | C.1∶2 | D.1∶4 |
强酸溶液A与强碱溶液B,在常温下其pH之和为15,当它们按一定体积比混合时,溶液的pH恰好为7,则A与B的体积比为
| A.1 : 1 | B.2 : 1 | C.1 : 10 | D.10 : 1 |
25 ℃时,将0.23 g钠投入到100 g水中充分反应,假设反应后溶液体积为100 mL,则该溶液的pH为
| A.1 | B.13 | C.12 | D.10 |
25℃时,向V mL pH=a的盐酸中,滴加10V mL pH=b的NaOH溶液,所得溶液中Cl-的物质的量恰好等于Na+的物质的量,则a+b的值是
| A.15 | B.14 | C.13 | D.不能确定 |
常温下,下列各组离子在指定溶液中一定能大量共存的是
| A.pH=1的溶液中:Fe2+、NO3-、SO42-、Na+ |
| B.无色溶液中:K+、Fe3+、SO42-、H+ |
| C.c (H+)/c (OH-) = 1012的溶液中:NH4+、Al3+、NO3-、Cl- |
| D.由水电离的c (H+)=1×10-14 mol/L的溶液中:Ca2+、K+、Cl-、HCO3- |
液氨与水的电离相似,存在微弱的电离:NH3+NH3 NH4++NH2-。对该体系的说法中错误的是
NH4++NH2-。对该体系的说法中错误的是
| A.液氨中c(NH4+)与c(NH2—)的乘积为一常数 |
| B.液氨电离达到各微粒的浓度保持不变 |
| C.只要不加入其它物质c(NH4+)=c(NH2-) |
| D.液氨中存在NH3、NH4+、NH2-、H2O、NH3·H2O等粒子。 |
常温下,向100 mL 0.01 mol·L-1 HA溶液中逐滴加入0.02 mol·L-1MOH溶液,图中所示曲线表示混合溶液的pH变化情况(体积变化忽略不计),则下列说法错误的是
| A.常温下,MA的水溶液的pH=a,由水电离产生的c(H+)=1×10-a mol·L-1 |
| B.在K点,水溶液中存在:c(M+) = 2c(A-) |
| C.在N点,水溶液中存在:c(M+) + c(H+)= c(A-)+ c(OH-) |
| D.在K点,若此时溶液的pH=10,则c(MOH)+c(M+)=0.01mol·L-1 |
t℃时,某NaOH稀溶液中,c(H+ )=10-amol·L-1,c(OH-)=10-bmol·L-1,已知a+b=13, 则在该温度下,将100 mL0.10 mol·L-1的稀硫酸与100 mL0.40 mol·L-1的NaOH溶液混合后,溶液的pH为( )(已知:忽略溶液混合时体积的变化;lg2=0.30;lg3=0.48)
| A.12.00 | B.11.82 | C.11.70 | D.11.52 |
在某NaHSO4溶液中离子的总浓度为0.06mol•L-1,若其中加入等体积离子总浓度为0.06mol•L-1的Ba(OH)2溶液,混合后溶液的体积不变,则溶液的pH值为
| A.2 | B.1.7 | C.12 | D.12.3 |
室温下,用0.100 mol·L-1 NaOH溶液分别滴定20.00ml 0.100 mol·L-1的盐酸和醋酸,滴定曲线如图所示。下列说法正确的是
| A.II表示的是滴定醋酸的曲线 |
| B.pH=7时,滴定醋酸消耗V(NaOH)小于20ml |
| C.V(NaOH) =20.00ml时,两份溶液中c(Cl—)=c(CH3COO—) |
| D.V(NaOH) =10.00ml时,醋酸溶液中:c(Na+)>c(CH3COO—)>c(H+)>c(OH—) |
在T ℃时, Ba(OH)2的稀溶液中c(H+)=10-a mol·L-1,c(OH-)=10-b mol·L-1,已知a+b=12。向该溶液中逐滴加入pH=4的盐酸,测得混合溶液的部分pH如下表所示:
| 序号 |
氢氧化钡溶液的体积/mL |
盐酸的体积/mL |
溶液的pH |
| ① |
22.00 |
0.00 |
8 |
| ② |
22.00 |
18.00 |
c |
| ③ |
22.00 |
22.00 |
d |
假设溶液混合前后的体积变化可忽略不计,则下列说法不正确的是
A.a = 8 B.b = 4 C.c = 5 D.d = 6
室温下向10mL0.1 mol•L-1NaOH溶液中加入0.1 mol•L-1的一元酸HA溶液,pH的变化曲线如图所示。下列说法正确的是
A.a点所示溶液中c(Na+)>c(A-)>c(H+)>c(HA)
B.a、b两点所示溶液中水的电离程度相同
C.b点所示溶液中c(A-)>c(HA)
D.滴定过程中不可能出现c(Na+)>c(OH-)>c(A-)>c(H+)
在不同温度下,水溶液中c(H+)与c(OH-)有如图所示关系。下列关于离子共存说法中正确的是( )

| A.d点对应的溶液中大量存在:Na+、K+、ClO-、Cl- |
| B.b点对应的溶液中大量存在:Fe2+、Ba2+、K+、NO3- |
| C.c点对应的溶液中大量存在:Na+、Ba2+、Cl-、Fe3+ |
| D.a点对应的溶液中大量存在:CO32-、Na+、Cl-、SO42- |
试题篮
()