室温下,下列溶液中粒子浓度关系正确的是
| A.0.01mol·L-1H2S溶液:c(H+)>c(HS-)>c(S2-)>c(H2S)>c(OH-) |
| B.0.1 mol·L-1NaHSO3溶液:c(Na+)+c(H+)<c(HSO3-)+c(SO32-)+c(OH-) |
| C.等物质的量的NH4Cl和NaCl的混合溶液:c(NH4) +c(NH3·H2O)+c(Na+)=2c(Cl-) |
| D.c(H+)/c(OH-)=10-10的Na2CO3溶液:c(HCO3-)+2c(H2CO3)=c(10-2-10-12) mol·L-1 |
向1000mL3mol·L-1NaOH中通入适量CO2气体,溶液中有关阴离子的物质的量变化曲线如图所示:
下列说法张正确的是
| A.水的电离程度一直增大 |
| B.溶液的pH逐渐下降 |
| C.M、N两点对应的溶液中离子种类不同 |
| D.CD段反应的离子方程式为OH-+CO2=HCO3- |
常温下,用0.1000mol/L的NaOH溶液滴定20ml同浓度的一元弱酸HA,滴定过程溶液pH随X的变化曲线如图所示(忽略中和热效应),下列说法不正确的是
A.HA溶液加水稀释后,溶液中 的值减小 的值减小 |
B.HA的电离常数 (x为滴定分数) (x为滴定分数) |
| C.当滴定分数为100时,溶液中水的电离程度最大 |
| D.滴定分数大于100时,溶液中离子浓度关系一定是c(Na+)>c(A-)>c(OH-)>c(H+) |
常温下,用 0.1000 mol·L-1NaOH溶液滴定 20.00mL某未知浓度的CH3COOH溶液,滴定曲线如图所示。已知在点③处恰好中和。下列说法错误的是
| A.该温度下CH3COOH的电离平衡常数约为1.8 ×10-5 |
| B.点①处溶液中c(CH3COO-)<c(CH3COOH) |
| C.点③处溶液中c(OH-)= c(CH3COOH)+c(H+) |
| D.滴定过程中不可能出现:c(CH3COOH) >c(CH3COO-)> c(OH-)> c(Na+)> c(H+) |
在一定条件下,Na2CO3溶液存在水解平衡: 。下列说法正确的是
。下列说法正确的是
| A.稀释溶液,水解平衡常数增大 |
| B.通入CO2,平衡朝正反应方向移动 |
C.升高温度, 减小 减小 |
| D.加入NaOH固体,溶液pH减小 |
常温下,下列关于电解质溶液的说法正确的是
| A.将pH=4的CH3COOH溶液加水稀释10倍,溶液中各离子浓度均减小 |
| B.用 CH3COOH溶液滴定等物质的量浓度的NaOH溶液至pH=7,V(CH3COOH溶液)<V(NaOH溶液) |
| C.向0.2 mol/L的盐酸溶液中加入等体积0.1 mol·L-1 NH3·H2O溶液:c(Cl–)+c(OH–)=c(H+)+c(NH3·H2O) |
| D.在含0.1mol NaHSO4的溶液中:c(H+)=c(SO42-)+c(OH–) |
下列有关说法正确的是
A.已知I2可溶于KI形成KI3,向两支盛有KI3溶液的试管中,分别滴加淀粉溶液和AgNO3溶液,前者溶液变蓝,后者有黄色沉淀,说明KI3溶液中存在平衡:I3- I2+I- I2+I- |
| B.物质的量浓度相等的H2CO3和Na2CO3溶液等体积混合后的溶液:c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+) |
| C.已知:Ksp(AgCl)=1.8×10-10,Ksp(Ag2CrO4)=2.0×10-12,将等体积的浓度为1.0×10-4mol/L的AgNO3溶液滴入到浓度均为1.0×10-4mol/L的KCl和K2CrO4的混合溶液中产生两种不同沉淀,且Ag2CrO4沉淀先产生 |
| D.25 ℃时,溶液中水电离出的c(H+)和水电离出的c(OH-)的乘积一定等于10-14 |
下列有关说法不正确的是
A.将物质的量浓度为10-3mol/L的醋酸和pH=11的NaOH溶液等体积混合后,溶液显碱性
B.如上图可表示常温下,稀释HA、HB两种酸的稀溶液时,溶液pH随加水量的变化,则同浓度的NaA溶液的pH大于NaB溶液
C.25℃时,pH=2的1.0 L醋酸溶液中水电离出的H+的数目为10-12NA
D.某吸热反应能自发进行,则该反应一定是熵增的反应
常温下,用0.1000 mol/L盐酸滴定25 mL 0.1000 mol/L Na2CO3溶液,滴定曲线如图。关于滴定过程中所得溶液相关微粒的浓度关系,下列说法正确的是
| A.a点:c(CO32-) >c(HCO3-) >c(Cl-) |
| B.b点:5c(Cl-)>4c(HCO3-)+4c(CO32-) |
| C.c点:c(OH-)=c(H+)+c(HCO3-)+2c(H2CO3) |
| D.d点:c(H+)=2c(CO32-)+c(HCO3-)+c(OH-) |
部分弱电解质的电离平衡常数如下表,以下选项错误的是
| 化学式 |
NH3·H2O |
CH3COOH |
HCN |
H2CO3 |
| Ki(25℃) |
1.8×l0—5 |
1.8×l0—5 |
4.9×l0—10 |
Ki1= 4.3×l0—7 Ki2= 5.6×l0—11 |
A.等物质的量浓度的NaHCO3和NaCN溶液,前者溶液中水的电离程度大
B.0.1 mol/L CH3COONa 溶液显碱性,0.1 mol/L CH3COONH4溶液显中性
C.CN-+H2O+CO2→HCN+ HCO3-
D.中和等体积、等pH的CH3COOH和HCN消耗NaOH的量前者小于后者
常温下,0.2 mol/L的一元酸HA与等浓度的NaOH溶液等体积混合后,所得溶液中部分微粒组分及浓度如图所示(a、b、d、e均为不超过1的正数),则下列说法正确的是
| A.该溶液pH=7 | B.该溶液中:c(A-)+c(Y)=c(Na+) |
| C.HA为强酸 | D.图中X表示HA,Y表示OH-,Z表示H+ |
室温下,用0.1mol/L氨水分别滴定20.0mL、0.1mol/L 的盐酸和醋酸,曲线如图所示,下列说法正确的
| A.I曲线表示的是滴定盐酸的曲线 |
| B.x=20 |
| C.滴定过程中c(NH4+)/c(NH3·H2O)的值逐渐减小 |
| D.当I曲线和II曲线pH均为7时,一溶液中的c(Cl-)等于另一溶液中的c(CH3COO-) |
下列关于离子的叙述正确的是
| A.在c(H+)=1×10-13mol·L-1的溶液中:Na+、Fe3+、Cl-、SO42-能大量共存 |
| B.铜溶于FeCl3溶液中:Cu + Fe3+ = Fe2+ + Cu2+ |
| C.NaHCO3溶液中:c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3) |
| D.向溶液中加入BaCl2溶液后再加盐酸,有白色沉淀,说明该溶液中一定含有SO42- |
40℃时,在氨-水体系中不断通入CO2,各种离子的变化趋势如下图所示。下列说法不正确的是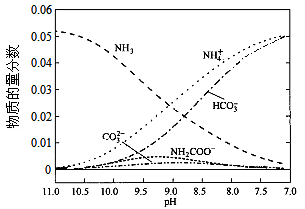
| A.在pH=9.0时,c(NH4+)>c(HCO3-)>c(NH2COOˉ)>c(CO32-) |
| B.不同pH的溶液中存在关系:c(NH4+)+c(H+)=2c(CO32-)+c(HCO3-)+c(NH2COOˉ)+c(OHˉ) |
C.随着CO2的通入, 不断增大 不断增大 |
| D.在溶液中pH不断降低的过程中,有含NH2COOˉ的中间产物生成 |
室温下,将0.05固体溶于水配成100
溶液,向溶液中加入下列物质。有关结论正确的是
| 加入的物质 |
结论 |
|
| A |
50 |
反应结束后, |
| B |
0.05 |
溶液中 |
| C |
50 |
由水电离出的 |
| D |
0.1 |
反应完全后,溶液 |
试题篮
()