在常温时,将V1 mL c1 mol·L-1 CH3COOH溶液中滴加到V2 mL c2mol·L-1NaOH溶液中,下列结论中,错误的是
| A.如果V1=V2,c 1= c 2,则混合溶液中c(CH3COO-) = c(Na+) |
| B.如果混合溶液的pH=7,则混合溶液中c(CH3COO-) = c(Na+) |
| C.如果混合溶液的pH>7,则不可能V1 c 1 = V2 c 2 |
| D.如果V1=V2,且混合溶液的pH<7,则c 1> c 2 |
下列各溶液中,微粒的物质的量浓度关系正确的是
| A.常温下,将pH="2的盐酸和pH=12的氨水等体积混合:" c(NH4+)>c(Cl-)> c(OH-)>c(H+) |
| B.0.1mol·L-1 Na2CO3溶液:c(Na+)=c(HCO3-)+2c(CO32-)+2c(H2CO3) |
| C.0.1mol·L-1 NH4Cl溶液:c(NH4+)="c(" Cl-) |
| D.向醋酸钠溶液加适量醋酸,得到的混合溶液:c(Na+)+ c(H+)=c(CH3COO-)+c(OH-) |
常温下,下列关系正确的是
| A.新制氯水中加入固体NaOH:c(Na+) = c(Cl−) + c(ClO−) + c(OH−) |
| B.pH = 8.3的NaHCO3溶液:c(Na+)>c(HCO3−)>c(CO32−)>c(H2CO3) |
| C.0.2mol/LCH3COOH溶液与0.1mol/LNaOH溶液等体积混合:2c(H+) – 2c(OH−) = c(CH3COO−) – c(CH3COOH) |
| D.向硝酸银溶液中逐滴滴加物质的量浓度相等的氯化钾和铬酸钾的混合溶液,若先产生白色的氯化银沉淀,则有:Ksp(AgCl)<Ksp(Ag2CrO4) |
碱式硫酸铁[Fe(OH)SO4]可用作净水剂、媒染剂、颜料和药物。工业上利用废铁屑(含少量氧化铝、氧化铁等),生产碱式硫酸铁的部分工艺如下: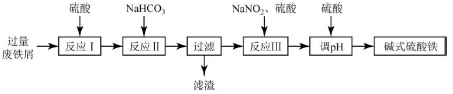
已知:部分阳离子以氢氧化物形式沉淀时溶液的pH见下表: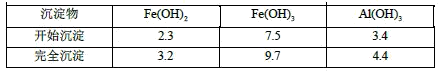
(1)反应I中发生的氧化还原反应的离子方程式是__________。
(2)反应II中加入NaHCO3调节体系的pH在____范围内。
(3)反应III中生成的气体遇空气变红棕色,则III中发生反应的离子方程式是_________ 。
(4)反应III中通入氧气可减少NaNO2的用量,若消耗1mol氧气可节约n(NaNO2)=____mol。
(5)用硫酸可知体系的pH。若硫酸加入量过小,溶液生成沉淀;若硫酸加入量过大,不利于产品形成,用化学平衡移动原理分析其原因是_________。
(6)碱式硫酸铁溶于水后生成的Fe(OH)2+离子可发生水解生成Fe2(OH)42+聚合离子,该水解反应的离子方程式是____________。
常温下,0.2mol·L-1NaHA与等浓度等体积的NaOH溶液混合,所得溶液中部分微粒组分及浓度如图所示,下列说法正确的是
A.NaHA溶液显酸性
B.混合溶液中水电离出的C(OH-)、C(H+)相等
C.图中X、Y、Z分别代表OH-、HA-、H+
D.混合溶液中:C(Na+)= C(H2A)+ C(HA-)+ C(A2-)
对下列电解质溶液的叙述错误的是
| A.等物质的量浓度的Na2CO3和NaHCO3混合液中:c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+) |
| B.25℃时,0.2 mol·L-1盐酸与等体积0. 05 mol.L-lBa(OH)2溶液混合后,溶液的pH=l |
| C.pH=3的二元弱酸H2R溶液与pH=11的NaOH溶液混合后,混合液的pH等于7,则反应后的混合液中:2c(R2-)+c(HR-)=c(Na+) |
| D.25℃时,若0.3 mol.L-1 HY溶液与0.3 mol.L-l NaOH溶液等体积混合后,溶液的 pH=9,则:c(OH-)一c(HY)=1×l0-9 mol.L-1 |
常温下,如果取0.1mol·L-1HCl溶液与0.1mol·L-1MOH溶液等体积混合(不计混合后溶液体积的变化),测得混合液的pH=5,请回答下列问题:
(1)混合后溶液的pH=5的原因(用离子方程式表示):
(2)混合溶液中由水电离出的H+浓度是0.1mol·L-1HCl溶液中由水电离出的H+浓度的 倍。
(3)求出混合溶液中下列算式的精确计算结果(填具体数字):
C(Cl-)-c(M+)= mol·L-1,c(H+)-c(MOH)= mol·L-1。
(4)已知CH3COOM溶液为中性,HF常温下电离常数为6.8×10-4,CH3COOH电离常为1.7×10-5。
则MF溶液的pH 7(填<、>、=);将同温下等物质的量浓度的四种盐溶液:
| A.MHCO3 | B.CH3COOM | C.MClO | D.MCl |
按pH由小到大的顺序排列: (填序号)。
(7分)按要求回答下列问题:
(1)向CH3COOH水溶液中加入水,平衡CH3COOH  H++CH3COO—将向 (填“正反应方向”、“逆反应方向”或“不”)移动,达到新的平衡状态时,溶液中c(CH3COO-)与原平衡时相比 (填“增大”、“减小”或“不变”),溶液中c(OH-) 与原平衡时相比 (填“增大”、“减小”或“不变”)。
H++CH3COO—将向 (填“正反应方向”、“逆反应方向”或“不”)移动,达到新的平衡状态时,溶液中c(CH3COO-)与原平衡时相比 (填“增大”、“减小”或“不变”),溶液中c(OH-) 与原平衡时相比 (填“增大”、“减小”或“不变”)。
(2)K通常表示化学平衡常数,对于反应Cl2+ H2O H++Clˉ+HClO其化学平衡常数K的表达式为: 。
H++Clˉ+HClO其化学平衡常数K的表达式为: 。
(3)下列说法中正确的是 。
| A.pH=1和pH=2的盐酸,c(H+)之比为1︰2 |
| B.某溶液中存在的离子只有Cl-、OH-、NH4+、H+,该溶液中离子浓度大小关系不可能为c(Cl-) > c(H+) > c(NH4+)>c(OH一) |
| C.0.1 mol·L-1的NaHCO3溶液中: c(Na+)>c(HCO3-) >c(CO32-) >c (H2CO3) |
| D.升高温度,弱电解质的电离常数一定增大 |
E.某温度下,相同体积、相同pH的盐酸和醋酸溶液分别加水稀释,pH随溶液体积V变化的曲线如图所示。II为醋酸稀释时pH的变化曲线,且a、b两点水的电离程度:a<b
常温下,用0.1000 mol/L HCl溶液滴定 20.00 mL 0.1000 mol/L NH3•H2O,溶液滴定曲线如下图。下列说法正确的是
| A.点①溶液中:c(C1—) >c(NH4+)>c(OH—) >c(H+) |
| B.点②溶液中:c(NH4+)>c(C1—)>c(OH—)>c(H+) |
| C.点③溶液中:c(C1—)>c(H+)>c(NH4+)>c(OH—) |
| D.滴定过程中可能出现: c(NH3•H2O)>c(NH4+)>c(OH—)>c(Cl—)>c(H+) |
已知某酸H2B在水溶液中存在下列关系:①H2B H++HB-,②HB-
H++HB-,②HB- H++B2-。关于该酸对应的酸式盐NaHB的溶液,下列说法中一定正确的是
H++B2-。关于该酸对应的酸式盐NaHB的溶液,下列说法中一定正确的是
A.NaHB属于弱电解质
B.溶液中的离子浓度c(Na+)>c(HB-)>c(H+)>c(OH-)
C.NaHB和NaOH溶液反应的离子方程式为H++OH-===H2O
D.c(Na+)=c(HB-)+c(B2-)+c(H2B)
常温下,H3PO4与NaOH溶液反应的体系中,含磷各物种的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与pH 的关系如图所示[已知Ca3(PO4)2难溶于水]。下列有关说法不正确的是
| A.H3PO4的Ka3=10-12.2,HPO42-的水解平衡常数为10-6.8 |
| B.Na2HPO4溶液显碱性,若向溶液中加入足量的CaCl2溶液,溶液则显酸性 |
| C.为获得尽可能纯的NaH2PO4,pH应控制在4~5.5左右 |
| D.pH=13时,溶液中各微粒浓度大小关系为:c(Na+)>c(HPO42-)>c(PO43-)>c(OH-)>c(H+) |
(1)将0.2mol/LHA(某一元酸)溶液与0.1mol/LNaOH溶液等体积混合,测得混合溶液中c(Na+)>c(A-),则此溶液中c(OH-)_______ c(H+), c(A-)_______c(HA);c(HA)+ c(A-)______0.1mol/L ;此溶液中由水电离出的c(OH-)______0.2mol/LHA溶液中由水电离出的c(H+)(填“>”、“<”或“=”)。
(2)将等体积pH=1的盐酸和醋酸,加入适量水,pH都升高了1,则加水后溶液体积V(醋酸)____V(盐酸)(填“>”、“<”或“=”)。
(3)常温下,某酸 (A为酸根)与某碱
(A为酸根)与某碱 溶液恰好完全反应生成正盐,该溶液
溶液恰好完全反应生成正盐,该溶液 。写出该正盐的化学式____,该盐中____离子一定能水解,其水解离子方程式为_______。
。写出该正盐的化学式____,该盐中____离子一定能水解,其水解离子方程式为_______。
下列有关电解质溶液的说法正确的是
| A.pH = a的氨水溶液,稀释10倍后,其pH = b,则a =" b" + 1 |
| B.向NaAlO2溶液中滴加NaHCO3溶液,有沉淀和气体生成 |
| C.在Na2C2O4稀溶液中,c(OH-) = c(H+) + c(HC2O4—) + 2c(H2C2O(4) |
| D.0.1 mol/L Na2CO3溶液与0.1 mol/L NaHCO3溶液等体积混合:3c(Na+) = 2[c(CO32—) + c(HCO3—) + c(H2CO(3)] |
下列有关电解质溶液中徽粒的物质的量浓度关系正确的是
| A.在0.1mol/LNaHCO3溶液中:c(Na+)>c(HCO3-)>c(CO32-)>c(H2CO3) |
| B.在0.1mol/LNa2CO3溶液中:c(OH-)+c(H+)=c(HCO3-)+2c(H2CO3) |
| C.向0.2mol/LNaHCO3溶液中加入等体积0.1mol/LnaOH溶液:c(CO32-)>c(HCO3-)>c(OH-)>c(H+) |
| D.常温下,CH3COONa和CH3COOH混合溶液pH=7,c(Na+)=c(CH3COO-)>c(H+)=c(OH-) |
常温下,下列说法不正确的是
A.等体积、等物质的量浓度的NaCl(aq) 离子总数大于NaClO(aq)中离子总数
B.pH=3的硫酸溶液中水的电离程度等于pH=11的氨水溶液中水的电离程度
C.0.1 mol/L的NaHA溶液pH=5,则溶液:c(HA-)>c(H+)>c(A2-)>c(H2A)
D.向NH4HSO4溶液中滴加NaOH溶液至中性,所得混合液:c(Na+)>c(NH4+)>c(SO42-)>c(OH-)=c(H+)
试题篮
()