常温下,0.1 mol·L-1HX的pH=1,0.1 mol·L-1CH3COOH的pH=2.9。下列说法不正确的是
| A.HX和CH3COOH均可抑制水的电离 |
| B.将HX与CH3COOH 各0.1mol溶于水配成1L混合溶液,则溶液的c(H+)="0.2" mol·L-1 |
| C.将等物质的量浓度、等体积的HX与CH3COONa两溶液混合后所得溶液中:c(Na+)>c(CH3COOH)>c(CH3COO-)>c(H+) |
| D.0.3mol·L-1的CH3COOK溶液:c(CH3COO-)+ c(CH3COOH)= c(K+) |
下列溶液中微粒的物质的量浓度关系正确的是
| A.氯水中:c(Cl2)=2c(ClO-)+2c(Cl-)+2c(HClO) |
| B.Na2CO3溶液:c(OH-)=c(HCO3-)+2c(H2CO3) +c(H+) |
| C.等浓度的NaClO、NaHCO3混合溶液中:c(HClO)+c(ClO-)=c(HCO3-)+c(H2CO3) |
| D.室温下,向0.01 mol·L-1 NH4HSO4溶液中滴加NaOH溶液至中性:c(Na+)>c(SO42-)>c(NH4+)>c(OH-)=c(H+) |
(16分)能源、环境与生产生活和社会发展密切相关。
(1)一定温度下,在两个容积均为2L的密闭容器中,分别发生反应:
| 容器 |
甲 |
乙 |
| 反应物投入量 |
1molCO2(g)和3molH2(g) |
1molCH3OH(g)和1molH2O(g) |
| 平衡时c(CH3OH) |
c1 |
c2 |
| 平衡时能量变化 |
放出29.4kJ |
吸收akJ |
CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H=-49.0kJ·mol-1。相关数据如下:
CH3OH(g)+H2O(g) △H=-49.0kJ·mol-1。相关数据如下:
①cl__________c2(填“>”、“<”或“=”),a=____________;
②该温度下反应的平衡常数K=__________;若甲中反应10s时达到平衡,则0~10s内甲中的平均反应速率v(H2)=__________。
③下列情况能说明该反应一定达到平衡状态的是________(填字母编号);
a.v(CO2)消耗=v(CH3OH)生成
b.气体的密度不再随时间改变
c.CO2和CH3OH的浓度之比不再随时间改变
d.气体的平均相对分子质量不再随时间改变
④其他条件不变,达到平衡后,下列不能提高H2转化率的操作是________(填字母编号)。
a.降低温度 b.充入更多的H2 c.移除甲醇 d.增大容器体积
(2)工业生产中H2S尾气可用NaOH溶液吸收。常温下,用a mol·L-1的NaOH溶液吸收尾气后得到的溶液中c(S2-)=c(OH-),此时溶液的pH=12,则此时溶液中的溶质为_________(填化学式),溶液中c(HS-)=__________mol·L-1(用含a的代数式表示,溶液体积变化忽略不计)。
某二元酸H2A在水溶液中以下列方式进行电离:H2A=H++HA- HA- H++A2-
H++A2-
下列说法正确的是
A.室温时,NaHA溶液pH<7,是由于HA-的电离程度大于其水解程度
B.在0.1 mol/L的Na2A溶液中:c(A2-) + c(HA-) + c(H2A) =" 0.1" mol/L
C.在0.1 mol/L的NaHA溶液中,一定有:c(Na+) > c(HA-) > c(H+) > c(A2-) > c(OH-)
D.向两份等体积NaHA、Na2A的浓度比为1 : 1的混合溶液中分别加入适当浓度的盐酸与氢氧化钠,其pH随加入酸、碱量的变化图像为:

将Cl2通人适量KOH溶液,产物中可能有KC1、KClO、KC1O3,且c(Cl-)/c(ClO-)的值与温度高低有关。当n(KOH)="a" mol时,下列有关说法不正确的是
| A.参加反应的氯气的物质的量等于1/2amol |
| B.改变温度,产物中KC1O3的最大理论产量为1/7amol |
| C.若某温度下,反应后c(Cl-)/c(ClO-)=11,则溶液中c(ClO-)/c(ClO3-)=1/2 |
| D.改变温度,反应中转移电子的物质的量ne的范围:1/2amol≤ne≤5/6amol |
已知某弱酸的酸式盐NaH2XO4和Na2HXO4,其中NaH2XO4溶液呈弱酸性,Na2HXO4呈弱碱性,在10℃时,浓度为0.1molL-的NaH2XO4和Na2HXO4溶液中均存在的关系是
| A.[C(H+)•C(OH-)]>1x10-14 |
| B.C(Na+)+C(H+)=C(H2XO4-)+c(OH-)+2C(HXO42-)+3c(XO43-) |
| C.C(H+)+2C(H3XO4)+C(H2XO4-)=C(XO43-)+C(OH-) |
| D.C(H+)+C(H3XO4)=C(HXO42-)+2C(XO43-)+C(OH-) |
已知H2C2O4是二元弱酸,NaHC2O4溶液显酸性。25℃时,将a mol/LH2C2O4溶液与b mol/LNaOH溶液等体积混合(0<a≤0.1,0<b≤0.1),下列有关溶液中微粒的物质的量浓度关系正确的是
| A.a=b时,c(H2C2O4)+c(H+)=c(C2O42-)+c(OH-) |
| B.a=b/2时,c(C2O42-)>c(HC2O4-)>c(H2C2O4)>c(OH-) |
| C.a=2b时,2c(Na+)=c(H2C2O4)+c(HC2O4-)+c(C2O42-) |
| D.a=3b时,c(Na+)+c(H+)=c(HC2O4-)+c(C2O42-)+c(OH-) |
下列溶液中各微粒的浓度关系不正确的是
| A.0.1 mol/LCH3COOH溶液中:c(CH3COO-)+ c(CH3COOH)=0.1mol/L |
| B.NaHCO3溶液中: c(OH-) = c(H+) + c(H2CO3)-c(CO32-) |
| C.CH3COONa溶液中:c(Na+)> c(CH3COO-)> c(OH-)> c(H+) |
| D.Na2S溶液中:2 c(Na+)= c(S2-) + c(HS-)+ c(H2S) |
25℃时下列叙述正确的是
| A.0.10mol·L-1的三种溶液:①NaCl、②NaOH、③CH3COONa,其pH大小顺序为:③>②>① |
| B.0.10mol·L-1NaHCO3溶液中:c(CO32-)+c(HCO3-)+c(H2CO3)=0.10mol·L-1 |
| C.pH=2的盐酸和pH=12的NaOH溶液中,水的离子积Kw不同 |
| D.与体积相同、pH=2的盐酸和醋酸完全反应,需要0.010mol·L-1 NaOH的体积相同 |
三种常见的酸(或碱)在水溶液中的电离情况如下表,下列说法正确的是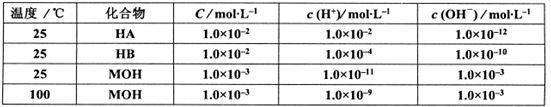
| A.温度相同,物质的量浓度也相同的MA和MB溶液,前者pH大于后者 |
B.pH相同的HA和HB的溶液中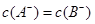 |
| C.相同浓度的MOH溶液,溶液的碱性随温度的升高而减弱 |
| D.25℃时MOH抑制水的电离,100℃时MOH促进水的电离 |
下列说法中正确的是
A.常温下,稀释0.1 mol/L的氨水,溶液中c(OH-)、c( )、c(H+)均下降 )、c(H+)均下降 |
B.常温下,c(N )相等的①(NH4)2SO4②(NH4)2Fe(SO4)2③NH4Cl④(NH4)2CO3溶液中,溶质物质的量浓度大小关系是:②<①<④<③ )相等的①(NH4)2SO4②(NH4)2Fe(SO4)2③NH4Cl④(NH4)2CO3溶液中,溶质物质的量浓度大小关系是:②<①<④<③ |
| C.pH=8.3的NaHCO3溶液:c(Na+)>c(HCO3-)>c(CO32-)>c(H2CO3) |
D.当溶液中存在的离子只有Cl-、OH-、 、H+时,该溶液中离子浓度大小关系可能为c(Cl-)>c( 、H+时,该溶液中离子浓度大小关系可能为c(Cl-)>c( )>c(OH-)>c(H+) )>c(OH-)>c(H+) |
亚氯酸钠是一种高效氧化剂漂白剂,主要用于 棉纺、亚麻、纸浆等漂白亚氯酸钠(NaClO2)在溶液中可生成ClO2、HClO2、ClO2-、Cl- 等,其中HClO2和ClO2都具有漂白作用,但ClO2是有毒气体。经测定,25℃时各组分含量随pH变化情况如图所示(Cl-没有画出)。则下列分析不正确的是
| A.亚氯酸钠在碱性条件下较稳定 |
| B.25℃时,HClO2的电离平衡常数的数值Ka=10-6 |
| C.使用该漂白剂的最佳pH为3 |
| D.25℃时,同浓度的HClO2溶液和NaClO2溶液等体积混合,混合溶液中有则c(HClO2)+ 2c(H+)=c(ClO2-)+ 2c(OH-) |
某温度下,体积和pH都相同的盐酸和氯化铵溶液加水稀释时的pH变化曲线如图所示,下列判断不正确的是
| A.a、b、c三点溶液的Kw相同 |
| B.b点溶液中c(H+)+c(NH3·H2O)=c(OH-) |
| C.用等浓度的NaOH溶液和等体积b、c处溶液反应,消耗NaOH溶液的体积Vb>Vc |
| D.a、b、c三点溶液中水的电离程度a>b>c |
常温下,向10mL b mol·L-1的CH3COOH溶液中滴加等体积的0.01 mol·L-1的NaOH溶液,充分反应后溶液中c(Na+)=c(CH3COO—),下列说法不正确的是
| A.b>0.01 |
| B.混合后溶液呈中性 |
C.CH3COOH的电离常数 |
| D.向CH3COOH溶液中滴加NaOH溶液的过程中,水的电离程度逐渐减小 |
25 ℃时,用0.100 0 mol·L-1 NaOH溶液滴定20 mL 0.100 0 mol·L-1一元酸HA(pKa="-lg" Ka=4.75)溶液,其滴定曲线如图所示,下列说法正确的是
A.当滴定到pH=4.75时,c(Na+)>c(A-)=c(HA)>c(OH-)
B.当溶液中c(H+)+c(OH-)=2×10-7时: c(Na+)=c(A-)>c(OH-)=c(H+)
C.当滴入NaOH溶液20 mL时,c(OH-)=c(H+)+c(HA)
D.当滴入40 mL NaOH溶液时,溶液中:c(Na+)>c(A-)>c(OH-)>c(H+)
试题篮
()