常温下,将等体积,等物质的量浓度的与
溶液混合,析出部分
晶体,过滤,所得滤液
。下列关于滤液中的离子浓度关系不正确的是()
| A. |
|
| B. |
|
| C. |
|
| D. |
|
氯碱工业以电解精制饱和食盐水的方法制取氯气、氢气、烧碱和氯的含氧酸盐等系列化工产品。下图是离子交换膜法电解食盐水的示意图,图中的离子交换膜只允许阳离子通过。

完成下列填空:
27.写出电解饱和食盐水的离子方程式。
28.离子交换膜的作用为:、。
29.精制饱和食盐水从图中位置补充,氢氧化钠溶液从图中位置流出(选填"a"、"b"、"c"或"d")。
30.可以和草酸(
)、硫酸反应生成高效的消毒杀菌剂
,还生成
和
等物质。
写出该反应的化学方程式。
31.室温下,0.1 mol/L 溶液的pH0.1 mol/L
溶液的pH(选填"大于"、"小于"或"等于")。浓度均为0.1 mol/L 的
和
的混合溶液中,
、
、
、
浓度从大到小的顺序为。
已知: Ki1=1.54×10-2 Ki2=1.02×10-7
Ki1=2.95×10-8
Ki1=4.3×10-7 Ki2=5.6×10-11
室温下,向下列溶液中通入相应的气体至溶液pH=7(通入气体对溶液体积的影响可忽略),溶液中部分微粒的物质的量浓度关系正确的是
| A.向0.10mol·L-1NH4HCO3溶液中通入CO2:c(NH4+)=c(HCO3-)+c(CO32-) |
| B.向0.10mol·L-1NaHSO3溶液中通入NH3:c(Na+)>c(NH4+)>c(SO32-) |
| C.0.10mol·L-1Na2SO3溶液通入SO2:c(Na+)=2[c(SO32-)+c(HSO3-)+c(H2SO3)] |
| D.0.10mol·L-1CH3COONa溶液中通入HCl:c(Na+)>c(CH3COOH)=c(Cl-) |
氨是合成硝酸、铵盐和氮肥的基本原料,回答下列问题:
(1)氨的水溶液显弱碱性,其原因为 (用离子方程式表示),0.1 mol·L-1的氨水中加入少量的NH4Cl固体,溶液的PH (填“升高”或“降低”);若加入少量的明矾,溶液中的NH4+的浓度 (填“增大”或“减小”)。
(2)硝酸铵加热分解可得到N2O和H2O,250℃时,硝酸铵在密闭容器中分解达到平衡,该分解反应的化学方程式为 ,平衡常数表达式为 ;若有1mol硝酸铵完全分解,转移的电子数为 mol。
(3)由N2O和NO反应生成N2和NO2的能量变化如图所示,若生成1molN2,其△H= kJ·mol-1。
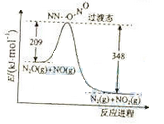
(本题共12分)Na2S2O3、Na2S、Na2SO3等含硫化合物在工业上有广泛的用途。
完成下列填空:
28.若将Na2S2O3中的硫元素看作为+2价,下列反应中与Na2S2O3+H2SO4(稀) → Na2SO4+S↓+SO2↑+H2O属于同一类型的是_______(填序号)。
a.2H2S+SO2→ 3S↓+2H2O
b.3NaClO 2NaCl+NaClO3
2NaCl+NaClO3
c.S+2H2SO4(浓)  3SO2↑+2H2O
3SO2↑+2H2O
d.4P+3NaOH+3H2O → 3NaH2PO2+PH3↑
29.棉织物用氯气漂白后,加入Na2S2O3除去余氯时,发生如下反应:
____S2O32―+____Cl2+________ → ___SO42―+___Cl―+___H+
完成并配平该反应方程式;若反应中生成0.2 mol SO42―,则转移电子___________mol。
30.下图是Na2SO3溶液中各离子浓度的相对大小关系示意图。其中,②是_______,④是______(填微粒符号)。
31.已知Na2S溶液显碱性,其主要原因是_________________(用离子方程式解释)。往装有Na2S溶液的烧杯中加入足量的ZnCl2溶液,产生白色的ZnS沉淀;再向烧杯中滴加CuCl2溶液,沉淀转变为黑色。请用溶解平衡原理解释上述现象______________________________________。
(本题共12分)
27.硫元素位于元素周期表第____列;硫元素原子核外有2个未成对电子,这2个电子所处亚层的符号是_______;硫、氯元素的原子均可形成与Ar原子电子层结构相同的简单离子,且硫离子的半径更大,请解释______________________________________。
28.S8和P4的分子中都只有共价单键,若P4分子中有6个P-P键,则可推断S8分子有________个S-S键;
己知:H-S键键能:339 kJ/mol; H-Se键键能:314kJ/mol。以上键能数据能否比较S,Se非金属性的强弱_______(选填“能”、“否”;下同);能否比较H2S、H2Se沸点的高低_______。
29.在25℃,Na2SO3溶液吸收SO2得到的NaHSO3溶液中c(SO32-)>c (H2SO3),据此断NaHSO3溶液显_____性。
30.在25℃,Na2SO3溶液吸收SO2后,若溶液pH=7.2,则溶液中c(SO32- )=c(HSO3-);若溶液pH=7,则以下浓度关系正确的是(选填编号)_____________________。
a.c(Na+)=2c(SO32-)+c(HSO3-)
b.c(Na+)> c(HSO3-)> c(SO32-)>c(H+)= c(OH-)
c.c(Na+)+ c(H+)=c(SO32-)+c(HSO3-)+c(OH-)
31.己知Na2SO3溶液中存在水解平衡:SO32-+H2O HSO3-+OH-,请用Na2SO3溶液和a试剂及必要的实验用品,设计简单实验,证明盐类的水解是一个吸热过程。a试剂是________,操作和现象是___________.
HSO3-+OH-,请用Na2SO3溶液和a试剂及必要的实验用品,设计简单实验,证明盐类的水解是一个吸热过程。a试剂是________,操作和现象是___________.
常温下,向10mL0.1mol·L-1NaOH溶液中逐滴加入0.1mol·L-1醋酸溶液,所得滴定曲线如图所示。下列说法正确的是
| A.pH=7时,所加醋酸溶液的体积为10mL |
| B.pH<7时,溶液中c(CH3COO-)>c(Na+) |
| C.7<pH<13时,溶液中c(Na+)>c(CH3COO-)>c(OH-)>c(H+) |
| D.继续滴加0.1mol·L-1醋酸溶液,溶液pH可以变为1 |
下列有关溶液的描述正确的是
| A.1 mol·L-1的FeCl3溶液中,Fe3+离子个数小于NA |
| B.Al3+和S2-,NO3-和S2-两组离子在酸、碱和中性溶液中均不能大量共存 |
| C.Ca(HCO3)2溶液与过量NaOH溶液反应的离子方程式:Ca2++HCO3-+OH-=CaCO3↓+2H2O |
| D.向10 mL 0.1 mol·L-1 CH3COONa溶液中加入5 mL 0.1 mol·L-1盐酸时,溶液中c(CH3COO-)>c(CH3COOH)>c(H+)>c(OH-) |
25时,将不同浓度的二元弱酸H2A和NaOH溶液等体积混合(体积变化忽略不计),测得反应后溶液的pH如下表:
| 实验编号 |
起始浓度/mol·L-1 |
反应后溶液的pH |
|
| c(H2A) |
c(NaOH) |
||
| ① |
X |
0.10 |
9 |
| ② |
0.10 |
0.10 |
5 |
下列判断不正确的是
A.X <0.1
B.HA-的电离程度大于水解程度
C.将实验①所得溶液加水稀释后,c(A2-)/c(HA-)变大
D.实验②所得溶液:c(Na+)=c(A2-)+c(HA-)+c(H2A)
常温下,向10mL b mol·L-1的CH3COOH溶液中滴加等体积的0.01 mol·L-1的NaOH溶液,充分反应后溶液中c(Na+)=c(CH3COO—),下列说法不正确的是
| A.b>0.01 |
| B.混合后溶液呈中性 |
C.CH3COOH的电离常数 |
| D.向CH3COOH溶液中滴加NaOH溶液的过程中,水的电离程度逐渐减小 |
下列溶液中各微粒浓度关系判定不正确的是
| A.10mL 0.2 mol·L-1的氨水与l0mL 0.1 mol·L-1的盐酸充分反应混合后的溶液中,存在c(NH4+)+c(NH3·H2O)=2c(Cl-)= 0.1 mol·L-1 |
| B.已知酸性HF > CH3COOH,物质的量浓度相等的NaF与CH3COOK溶液中:c(Na+) - c(F-) >c(K+) - c(CH3COO-) |
| C.CH3COOK溶液中加入少量NaNO3固体后的碱性溶液一定有:c(K+)+c(H+)=c(CH3COO-)+c(OH-) |
| D.NaHSO3溶液中一定有:c(Na+)>c(HSO3-)>c(SO32-)>c(H2SO3) |
有关下列两种溶液的说法中,不正确的是
①0.2 mo1·L-1 CH3COONa溶液 ②0.1 mo1·L-1H2SO4溶液
| A.相同温度下,溶液中水的电离程度:①>② |
| B.向①加水后所得溶液c(CH3COO-)/c(CH3COOH)的比值变大 |
| C.等体积混合溶液①和溶液②,所得溶液中2c(SO42-) = c(Na+) |
| D.25℃时,向溶液②中滴加溶液①至pH = 7,溶液中c(Na+) >c(CH3COO-) + c(SO42-) |
常温下,用0.10 mol·L—1NaOH溶液分别滴定20.00 mL浓度均为0.10 mol·L—1 CH3COOH溶液和HCN溶液所得滴定曲线如右图。下列说法正确的是
| A.点①和点②所示溶液中:c(CH3COO—)< c(CN—) |
| B.点③和点④所示溶液中:c(Na+)>c(OH—) >c(CH3COO—) >c(H+) |
| C.点①和点②所示溶液中: c(CH3COO—)-c(CN—) =" c(HCN)-" c(CH3COOH) |
| D.点②和点③所示溶液中都有:c(CH3COO—)+c(OH—)= c(CH3COOH) +c(H+) |
下列说法正确的是
| A.由图甲可知,升高温度醋酸钠的水解程度增大 |
| B.由图乙可知,a点Kw的数值比b点Kw的数值大 |
C.由图丙可知,反应A(g)+B(g) 2C(g)是吸热反应 2C(g)是吸热反应 |
| D.由图丁可知,反应C(金刚石,s)= C(石墨,s)的焓变△H=△H1—△H2 |
25℃时,下列叙述正确的是
| A.NH4HSO4溶液中滴加NaOH溶液至pH=7,则c(Na+)=2c(SO42-) |
| B.0.1 mol·L-1CH3COOH溶液与0.1 mol·L-1CH3COONa等体积混合pH<7,则c(CH3COO-)>c(Na+)>c(CH3COOH)>c(H+)>c(OH-) |
| C.AgCl在水中溶解度与在稀盐酸中溶解度相同 |
| D.KNO3溶液和CH3COONH4溶液pH均为7,则两溶液中水的电离程度相同 |
试题篮
()