(17分)铁及其化合物应用广泛。
(1)三氯化铁是一种水处理剂,工业制备无水三氯化铁固体的部分流程如下图: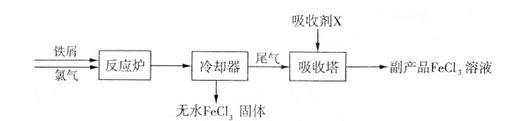
①检验副产品中含有X时,选用的试剂是 (填下列各项中序号)。
a.NaOH溶液 b.KSCN溶液 c.酸性KMnO4溶液 d.铁粉
②在吸收塔中,生成副产品FeCl。的离子方程式为
(2)高铁酸钾(K2FeO4)也是一种优良的水处理剂,工业上,可用铁作阳极,电解KOH溶液制备高铁酸钾。电解过程中,阳极的电极反应式为 ;电解一段时间后,若阳极质量减少28 g,则在此过程中,阴极析出的气体在标准状况下的体积为 L。
(3)硫化亚铁常用于工业废水的处理。
①你认为,能否用硫化亚铁处理含Cd2+的工业废水? (填“能”或“否”)。请根据沉淀溶解平衡的原理解释你的观点(用必要的文字和离子方程式说明):
(已知:25℃时,溶度积常数Ksp(FeS)=6.3×10-18、Ksp(CdS)=3.6×10-29)
②工业上处理含Cd2+废水还可以采用加碳酸钠的方法,反应如下:2Cd2++2CO32-+H2O===Cd2(OH)2CO3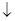 +A。则A的化学式为 。
+A。则A的化学式为 。
25℃时,由弱酸(HA)及其盐(NaA)组成的混合溶液,起始浓度均为1mol·L-1。下图为向该溶液中通入HCl气体或加入NaOH固体时,溶液pH随加入H+或OH-的物质的量而变化的曲线。下列说法中,不正确的是
A.A、B、C三点所表示的溶液中水的电离程度依次增大
B.通入HCl,HA的电离常数减小,A-的水解程度增大
C.加入1 mol NaOH后,溶液中c(Na+)=c(A-)
D.未加HCl和NaOH时,溶液中c(A-)>c(Na+)>c(HA)
常温下,向100 mL 0.0l mol.L-lHCl的溶液p 中逐滴加入0. 02 mol.L-lMOH溶液的过程中,其pH变化如图所示(溶液体积变化忽略不计).下列说法中正确的是
| A.MOH为一元强碱 |
| B.N点水的电离程度小于K点水的电离程度 |
| C.在K点,c(M+)>c(Cl-)>c(OH-)>c(H+) |
| D.K点对应的溶液中,有c( MOH) +c( M+)="0.02" mol.L-1 |
常温下,一元酸HA溶液和NaOH溶液等体积混合(忽略体积变化),实验数据如下表:
| 实验编号 |
起始浓度/(mol·L-1) |
反应后溶液的pH |
|
| c(HA) |
c(NaOH) |
||
| ① |
0.1 |
0.1 |
9 |
| ② |
x |
0.2 |
7 |
| ③ |
0.2 |
0.1 |
4.8 |
| ④ |
0.1 |
0.2 |
y |
下列判断正确的是
A.实验①反应后的溶液中:c(HA)约为 mol·L-1
mol·L-1
B.实验②反应后的溶液中:c(HA)>c(Na+)=c(A-)>c(H+)=c(OH-)
C.实验③反应后的溶液中:c(HA)+c(H+)=c(OH-)+c(A-)
D.实验④反应后的溶液中:c(OH-)-c(H+)-c(HA)=0.05 mol·L-1
下列关于各图象的解释或得出的结论正确的是
| A.图1表示用0.10 mol·L-1 NaOH溶液滴定20.00 mL 0.10 mol·L-1醋酸溶液的滴定曲线 |
| B.图2表示乙酸溶液中通入氨气至过量过程中溶液导电性I的变化 |
| C.根据图3所示可知:石墨比金刚石稳定 |
D.图4表示反应2SO2+O2 2SO3,t1时刻只减小了的SO3的浓度 2SO3,t1时刻只减小了的SO3的浓度 |
25℃时,向10 mL 0.1 mol·L-1 CH3COONa溶液中加入0.1 mol·L-1盐酸,溶液pH随加入盐酸的体积变化情况如图所示。下列说法正确的是
| A.点①所示溶液中:c(OH-)=c(H+)+c(CH3COOH) |
| B.点②所示溶液中:c(CH3COOH)+c(CH3COO-)=0.05 mol·L-1 |
| C.点③所示溶液为等物质的量浓度的中:c(CH3COO-)>c(CH3COOH)>c(H+)>c(OH-) |
| D.点④所示溶液中:c(Na+)+c(H+)<c(CH3COO-)+c(Cl-) |
25℃时,向10 mL 0.1 mol·L-1 CH3COONa溶液中加入0.1 mol·L-1盐酸,溶液pH随加入盐酸的体积变化情况如图所示。下列说法正确的是
| A.点①所示溶液中:c(OH-)=c(H+)+c(CH3COOH) |
| B.点②所示溶液中:c(CH3COOH)+c(CH3COO-)=0.05 mol·L-1 |
| C.点③所示溶液中:c(CH3COO-)>c(CH3COOH)>c(H+)>c(OH-) |
| D.点④所示溶液中:c(Na+)+c(H+)<c(CH3COO-)+c(Cl-) |
室温下,用0.100 mol/L NaOH溶液分别滴定20.00 mL 0.100 mol/L的盐酸和醋酸,滴定曲线如图所示。下列说法正确的是
| A.Ⅰ、Ⅱ分别表示盐酸和醋酸的滴定曲线 |
B.V(NaOH)=10.00 mL 时, >1 >1 |
| C.pH=7时,两种酸所用NaOH溶液的体积相等 |
| D.V(NaOH)=20 .00 mL 时,c(Cl-)<c(CH3COO-) |
下列叙述不正确的是
| A.NH4Cl溶液加水稀释后,恢复至原温度,pH和KW均增大 |
| B.0.1 mol/L CH3COONa溶液中:c(Na+)>c(CH3COO-)>c(OH-)>c(H+) |
| C.pH=4的CH3COOH溶液和pH=4的NH4Cl溶液中,c(H+)相等 |
| D.在NaHCO3溶液中:c(OH—)+c(CO32—)=c(H+)+c(H2CO3) |
经测定某溶液中离子只有Na+、Ac—、H+、OH—四种,且离子浓度大小的排列顺序为:c(Ac—)>c(Na+)>c(H+)>c(OH—),则不可能的情形是
| A.由pH=3的HAc与pH=11的NaOH溶液等体积混合而成 |
| B.由0.2 mol/L HAc溶液与0.1 mol/L NaOH溶液等体积混合而成 |
| C.由0.1 mol/L HAc溶液与等物质的量浓度等体积的NaOH溶液混合而成 |
| D.向上述溶液中加入适量NaOH,可能使溶液中离子浓度大小改变为: c(Ac—) > c(Na+) > c(OH—) > c(H+) |
常温下,测得某溶液NaHX的pH >7,该溶液中有关浓度关系式正确的是
| A.c(Na+) > c(H+)+c(X2-) |
| B.c(Na+)=c(H2X)+c(HX-)+c(X2-) |
| C.c(X2-)> c(H2X) |
| D.c(Na+)+ c(H+)=c(OH-)+c(HX-)+c(X2-) |
下列各实验中,有关浓盐酸作用的表述错误的是
| A.配制CuCl2溶液时,将CuCl2(s) 溶于浓HCl后再加水冲稀。浓盐酸作用:有利于抑制CuCl2水解,可防止Cu(OH)2的形成。 |
| B.加热MnO2的浓HCl溶液制取氯气。浓盐酸作用:有利于减少氯气的溶解损失。 |
| C.浓硝酸不能溶解金,需用浓HCl溶液配制王水才能溶解金。浓盐酸作用:有利于增强Au的还原性,并且提高硝酸的氧化性。 |
| D.将浓硫酸滴入浓盐酸中制备HCl气体。浓盐酸作用:增大溶质的浓度,有利于促进平衡向气体溶解的逆方向移动 |
25℃时,醋酸、次氯酸、亚硝酸的电离常数如下表,下列叙述不正确的是
| 酸 |
醋酸 |
次氯酸 |
亚硝酸 |
| 电离常数 |
1.7×10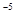 |
3.0×10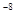 |
7.1×10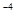 |
A.PH相同的氯水和亚硝酸溶液,水电离出的C(H+)相同
B.往氯水滴加NaOH溶液呈中性:C(Na+)=2C(ClO-)+C(HClO)
C.浓度相等的CH3COONa和NaNO2两份溶液中:C(CH3COO-)>C(NO2-)
D.向pH=a的醋酸溶液中加一定量水,所得溶液的pH>a、pH<a、pH=a均有可能
下列事实说明HNO2为弱电解质的是
①0.1 mol/L HNO2溶液的pH=2.1;
②常温下NaNO2溶液的pH>7 ;
③用HNO2溶液做导电实验时,灯泡很暗;
④HNO2溶液和KCl溶液不发生反应
⑤HNO2能与碳酸钠反应制CO2;
⑥HNO2不稳定,易分解
| A.①②③⑤ | B.①② | C.①②⑥ | D.①②④⑤ |
试题篮
()