【原创】下列溶液中粒子的物质的量浓度关系正确的是
A.0.1 mol/L的NaOH溶液与0.2 mol/L的HA溶液等体积混合,所得溶液呈碱性:c (Na+)>c (HA)>c (A-)>c (OH-)>c (H+)
B.向CH3COONa溶液中通入氯化氢后得到的中性溶液中:c(Na+)>c(Cl-)=c(CH3COOH)
C.0.1 mol·L-1氨水加水稀释,溶液中c(H+)和c(OH-)均减小
D.浓度均为0.1 mol·L-1的HClO、NaClO的混合溶液中:2c(OH-)=2c(H+)+c(HClO)
已知常温下CH3COOH和NH3•H2O 的电离常数相等,现向10mL浓度为0.1mol•L‾1的氨水溶液中滴加相同浓度的CH3COOH溶液,在滴加过程中,下列说法错误的是
| A.c(NH4+)/c(NH3•H2O)始终减小 |
| B.水的电离程度先增大再减小 |
| C.滴定过程可用上图像表示 |
| D.当溶液中c(NH4+)=c(CH3COO‾)时,所加入醋酸溶液的体积为10mL |
【改编】常温下,电解质溶液的性质与变化是多样的,下列说法正确的是
A.物质的量浓度相同的①CH3COONa ②NaClO ③NaOH三种溶液c(OH—)大小:③>②>①
B.往氯化铵溶液中加水, 的值变大
的值变大
C.将0.2mol/L的某一元酸HA溶液和0.1mol/L NaOH溶液等体积混合后溶液pH大于7,则充分反应后的混合液:2c(OH-)=2c(H+)+c(HA)-c(A-)
D.Ca(ClO) 2溶液中通入少量CO2,溶液的导电性和酸性均增强
【改编】下列有关电解质溶液中粒子浓度关系正确的是
| A.pH=1的NaHSO4溶液:c(H+)=c(SO42-) |
| B.含有AgCl和AgI固体的悬浊液:2c(Ag+)=c(C1-)+c(I-) |
| C.pH相等的①NH4Cl ②NH4Al(SO4)2③NH4HSO4溶液中:c(NH)大小顺序:①>②>③ |
| D.含等物质的量的NaHC2O4和Na2C2O4的溶液:2c(Na+)=3c(HC2O4-)+ 3c(C2O42-) |
室温下,用0.100mol/L 盐酸溶液滴定20.00mL 0.100mol/L的某氨水溶液,滴定曲线如图所示,下列有关说法不正确的是
| A.曲线上除d点外任意一点所示溶液中:c(NH4+ )+c(H+)= c(Cl—)+ c(OH-) |
| B.a点所示溶液中, c(Cl— ) > c(NH4+ )> c(NH3·H2O)> c(OH-)> c(H+) |
| C.b点所示溶液中,c(NH4+ )= c(Cl— ) |
| D.c点所示溶液中, c(Cl— ) > c(NH4+ ) > c(H+)>c(NH3·H2O) |
现有1.0 mol/L的NaOH溶液0.2L,若通入4.48L(标准状况)SO2气体使其充分反应后,则所得溶液中各粒子浓度大小关系正确的是
| A.c(Na+) = c(H2SO3) + c(HSO3―) + c ( H+) |
| B.c(SO32―) + c( OH―) = c(H+) + c(H2SO3) |
| C.c(Na+)+c(H+) = c(HSO3―) +c(SO32―) + c( OH―) |
| D.c(Na+)>c(HSO3―)>c( OH―)>c(H2SO3)>c(SO32―)>c(H+) |
叠氮酸(HN3)与醋酸酸性相似,下列叙述中错误的是
| A.HN3水溶液中微粒浓度大小顺序为:c(HN3)>c(H+)>c(N3-)>c(OH-) |
| B.HN3与NH3作用生成的叠氮酸铵中全都是共价键 |
| C.NaN3水溶液中离子浓度大小顺序为:c(Na+)>c(N3-) >c(OH-)>c(H+) |
| D.N3-与CO2含相等电子数 |
将0.1 mol/L的HA溶液与0.1 mol/L的NaOH溶液等体积混合后,测得混合溶液pH=8,则溶液中有关微粒的浓度关系正确的是
A.c(HA)+c(A-)=c(Na+)=0.1mol/L
B.c(Na+)-c(A-)=c(OH-)-c(H+)
C.c(A-)>c(Na+)>c(OH-)>c(H+)
D.c(OH-)>c(H+)+c(HA)
常温下,取pH=2的两种二元酸H2A与H2B各1 mL,分别加水稀释,测得pH变化与加水稀释倍数有如图所示变化,则下列有关叙述正确的是
A.H2A为二元弱酸
B.PH=4的NaHA水溶液中离子浓度大小为c(Na+)>c(HA-)>c(A2-)>c(H2A)>c(OH-)
C.含NaHA、NaHB的混合溶液中,离子浓度大小为c(Na+)=c(A2-)+c(HB-)+c(B2-)
D.Na2B的水溶液中,离子浓度大小为c(Na+)>c(B2-)>c(OH-)>c(H+)
常温下,0.2 mol/L的一元酸HA与等浓度的NaOH溶液等体积混合后,所得溶液中部分微粒组分及浓度如图所示,下列说法正确的是
| A.HA为强酸 |
| B.该混合液pH=7 |
| C.图中X表示HA,Y表示OH-,Z表示H+ |
| D.该混合溶液中:c(A-)+c(Y)=c(Na+) |
25℃时,下列有关溶液中微粒的物质的量浓度关系正确的是
| A.在0.1 mol·L-1 NH4Cl溶液中:c(H+)=c(NH3·H2O)+c(OH-) |
| B.10 mL 0.1 mol·L-1 CH3COONa溶液与6 mL 0.2 mol·L-1盐酸混合:c(Cl-) > c(Na+) > c(OH-) > c(H+) |
| C.0.1 mol·L-1 NH4HSO4溶液与0.1 mol·L-1 NaOH溶液等体积混合:c(Na+) = c(NH4+) > c(H+) > c(OH-) |
| D.0.1 mol·L-1 HCN溶液和0.05 mol·L-1 NaOH溶液等体积混合(pH>7):c(HCN) + c(H+) > c(OH-) + c(CN-) |
甲、乙、丙三种物质均由短周期元素组成,一定条件下,存在下列转化关系:
甲+乙→丙+H20
(1)若丙为Na2C03,反应的化学方程式为 (任写一个)。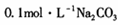 溶液中,所含的离子按物质的量浓度由大到小的顺序排列为 。
溶液中,所含的离子按物质的量浓度由大到小的顺序排列为 。
(2)若甲是石油裂解气的主要成分之一,乙为O2,且甲分子和乙分子具有相同的电子数。25℃、101 kPa时,1g甲完全燃烧生成CO2气体与液态水,放出50.5 kJ的热量,该反应的热化学方程式为 ;利用该反应设计的燃料电池中,通入甲的电极为电池的 (填“正极”或“负极”)。
(3)若甲、乙是同主族元素的化合物,丙为单质。
①丙所含元素在元素周期表中的位置为
②甲与水相比,热稳定性较强的是 (填化学式)。
溶液中,有关物质的量浓度关系正确的是
A.向硝酸钠溶液中滴加稀盐酸得到的pH=5的混合溶液:c(Na+)=c(NO3—)
B.1.0 mol.L-1·Na2C2O4溶液:c(OH-)=c(HC2O4—)十c(H+)+ c(H2C2O4)
C.pH=8.0的KHS溶液中,c(K+)>c(HS-)>c(OH-)>c(S2-)>c(H+)
D.将0.2 mol.L-1的某一元酸HA溶液和0.1 mol.L-1NaOH溶液等体积混合后,溶液pH大于7,则反应后的混合液中:c(OH-)+c(A一)=c(H+)+c(HA)
如图是草酸溶液中 三种微粒的分布分数(某微粒物质的量浓度与三种微粒物质的量被度和的比值)与pH的关系,下到有关说法不正确的是
三种微粒的分布分数(某微粒物质的量浓度与三种微粒物质的量被度和的比值)与pH的关系,下到有关说法不正确的是
A.pH=5的溶液中  |
B. 溶液中: 溶液中:  |
C.向 溶液中加强酸至pH与a点对应时,溶液中 溶液中加强酸至pH与a点对应时,溶液中 |
D.为使溶液中c( )尽可能多一些,溶液的pH最好控制在2.7左右 )尽可能多一些,溶液的pH最好控制在2.7左右 |
工业废渣、废水回收利用是重要研究课题。下面流程是生产食用香料正丁酸乙酯的工厂废水(含乙醇、正丁酸乙酯、正丁酸、乙醚和大量无机悬浮物)联合利用电子工业废料(含SiO2和Cu2(OH)2CO3)回收铜的工艺设计。
回答下列问题:
(1)初沉加入的试剂是明矾,写出参与净水的离子的水解方程式: 。
(2)固体X的成分是 ,反应I的化学反应方程式 。
(3)试剂Y为 ;加快反应II速率的措施有(任写一条) 。
(4)反应Ⅲ的离子方程式为: 。
(5)硅胶在生活与生产中用途广泛,写出其中一种用途 。
试题篮
()