直接排放含SO2的烟气会形成酸雨,危害环境。利用钠碱循环法可脱除烟气中的SO2。
(1)用化学方程式表示SO2形成硫酸型酸雨的反应:______________________________________________________________。
(2)在钠碱循环法中,Na2SO3溶液作为吸收液,可由NaOH溶液吸收SO2制得,该反应的离子方程式是____________________________________________________。
(3)吸收液吸收SO2的过程中,pH随n(SO32-)∶n(HSO3-)变化关系如下表:
| n(SO32-)∶n(HSO3-) |
91∶9 |
1∶1 |
9∶91 |
| pH |
8.2 |
7.2 |
6.2 |
①由上表判断,NaHSO3溶液显________性,用化学平衡原理解释:_____________。
②当吸收液呈中性时,溶液中离子浓度关系正确的是(选填字母):________。
a.c(Na+)=2c(SO32-)+c(HSO3-)
b.c(Na+)>c(HSO3-)>c(SO32-)>c(H+)=c(OH-)
c.c(Na+)+c(H+)=c(SO32-)+c(HSO3-)+c(OH-)
(4)(2012·福建高考节选)能证明Na2SO3溶液中存在SO32-+H2O HSO3-+OH-水解平衡的事实是________(填序号)。
HSO3-+OH-水解平衡的事实是________(填序号)。
A.滴入酚酞溶液变红,再加入H2SO4溶液后红色褪去
B.滴入酚酞溶液变红,再加入氯水后红色褪去
C.滴入酚酞溶液变红,再加入BaCl2溶液后产生沉淀且红色褪去
X、Y、Z、Q、R是五种短周期元素,原子序数依次增大。X、Y两元素最高正价与最低负价之和均为0;Q与X同主族;Z、R分别是地壳中含量最高的非金属元素和金属元素。
请回答下列问题:
(1)五种元素原子半径由大到小的顺序是(写元素符号)________。
(2)由以上某些元素组成的化合物A、B、C、D有如下转化关系:
A B(在水溶液中进行)
B(在水溶液中进行)
其中C是溶于水显酸性的气体;D是淡黄色固体。
写出C的结构式________;D的电子式________。
①如果A、B均由三种元素组成,B为两性不溶物,则A的化学式为____________;由A转化为B的离子方程式为_____________________________________________。
②如果A由三种元素组成,B由四种元素组成,A、B溶液均显碱性。用离子方程式表示A溶液显碱性的原因:________________________________________。A、B浓度均为0.1 mol·L-1的混合溶液中,离子浓度由大到小的顺序是__________________;常温下,在该溶液中滴加稀盐酸至中性时,溶质的主要成分有_______________________________。
某化学学习小组为研究HA、HB和MOH的酸碱性的相对强弱,设计以下实验:常温下将pH=2的两种酸溶液HA、HB和pH=12的MOH碱溶液各1 mL,分别加水稀释到1 000 mL,其pH的变化与溶液体积的关系如图,根据所给的数据,请回答下列问题:
(1)HA为 酸,HB为 酸(填“强”或“弱”)。
(2)若c=9,则稀释后的三种溶液中,由水电离的氢离子浓度的大小顺序为 (用酸、碱化学式表示)。
(3)若c=9,将稀释后的HA溶液和MOH溶液取等体积混合,则所得溶液中c(A-)与c(M+)的大小关系为c(A-) (填“大于”、“小于”或“等于”)c(M+)。
(4)若b+c=14,则MOH为 碱(填“强”或“弱”)。将稀释后的HB溶液和MOH溶液取等体积混合,所得混合溶液的pH 7(填“大于”、“小于”或“等于”)。
科研、生产中常涉及钠、硫及其化合物。
(1)实验室可用无水乙醇处理少量残留的金属钠,化学反应方程式为 。要清洗附着在试管壁上的硫,可用的试剂是 。
(2)如图为钠高能电池的结构示意图,该电池的工作温度为320 ℃左右,电池反应为2Na+xS=Na2Sx,正极的电极反应式为 。M(由Na2O和Al2O3制得)的两个作用是 。
与铅蓄电池相比,当消耗相同质量的负极活性物质时,钠硫电池的理论放电量是铅蓄电池的 __ 倍。
(3)Na2S溶液中离子浓度由大到小的顺序为 ,向该溶液中加入少量固体CuSO4,溶液pH (填“增大”、“减小”或“不变”),Na2S溶液长期放置有硫析出,原因为 (用离子方程式表示)。
已知:常温下浓度为0.1 mol·L-1的下列溶液的pH如表:
| 溶质 |
NaF |
NaClO |
Na2CO3 |
| pH |
7.5 |
9.7 |
11.6 |
下列有关说法正确的是
A.在相同温度下,同浓度的三种酸溶液的导电能力顺序:H2CO3<HClO<HF
B.若将CO2通入0.1 mol·L-1Na2CO3溶液中至溶液中性,则溶液中2 c (CO32ˉ)+ c (HCO3ˉ)=" 0.1" mol·L-1
C.根据上表,水解方程式ClOˉ+ H2O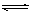 HClO + OHˉ的平衡常数K≈10ˉ7.6
HClO + OHˉ的平衡常数K≈10ˉ7.6
D.向上述NaClO 溶液中通HF气体至恰好完全反应时:c(Na+)>c(Fˉ)>c(H+)>c(HClO)>c(OHˉ)
25 ℃时,有关物质的电离平衡常数如下:
| 化学式 |
CH3COOH |
H2CO3 |
HClO |
| 电离平 衡常数 |
K=1.8×10-5 |
K1=4.3×10-7 K2=5.6×10-11 |
K=3.0×10-8 |
回答下列问题。
(1)物质的量浓度为0.1 mol·L-1的下列四种物质,pH由大到小的顺序是________(填编号)。
a.Na2CO3 b.NaClO
c.CH3COONa d.NaHCO3
(2)常温下0.1 mol·L-1的CH3COOH溶液加水稀释过程中,下列各量一定变小的是________(填编号)。
A.c(H+) B.c(CH3COO-)
C.c(H+)·c(OH-) D.
(3)体积均为10 mL、pH均为2的醋酸溶液与HX溶液分别加水稀释至1 000 mL,稀释过程中pH变化如图所示。则HX的电离平衡常数________(填“大于”、“等于”或“小于”)醋酸的电离平衡常数,理由是__________________;稀释后,HX溶液中水电离出来的c(H+)________(填“大于”、“等于”或“小于”)醋酸溶液中水电离出来的c(H+),理由是_________________________________________________________________。
(4)25 ℃时,若测得CH3COOH与CH3COONa的混合溶液的pH=6,则溶液中c(CH3COO-)-c(Na+)=________(填精确数值)。
某二元酸(化学式用H2B表示)在水中的电离方程式是H2B=H++HB-;HB-H++B2-。回答下列问题。
(1)Na2B溶液显________(填“酸性”、“中性”或“碱性”),理由是________________(用离子方程式表示)。
(2)在0.1 mol·L-1的Na2B溶液中,下列粒子浓度关系式正确的是________。
A.c(B2-)+c(HB-)+c(H2B)=0.1 mol·L-1
B.c(Na+)+c(OH-)=c(H+)+c(HB-)
C.c(Na+)+c(H+)=c(OH-)+c(HB-)+2c(B2-)
D.c(Na+)=2c(B2-)+2c(HB-)
(3)已知0.1 mol·L-1 NaHB溶液的pH=2,则0.1 mol·L-1 H2B溶液中的氢离子的物质的量浓度可能________0.11 mol·L-1(填“<”、“>”或“=”),理由是_________________________________________________________________。
(4)0.1 mol·L-1 NaHB溶液中各种离子浓度由大到小的顺序是_____________。
镍电池广泛应用于混合动力汽车系统,电极材料由Ni(OH)2、炭粉、氧化铁等涂覆在铝箔上制成.由于电池使用后电极材料对环境有危害,某兴趣小组对该电池电极材料进行资源回收研究,并设计出相关实验流程图
已知:①NiCl2易溶于水,Fe3+不能氧化Ni2+
②某温度下一些金属氢氧化物的Ksp及沉淀析出的理论pH如表所示:
| M(OH)n |
Ksp |
pH |
|
| 开始沉淀 |
沉淀完全 |
||
| Al(OH)3 |
1.9×10-33 |
3.43 |
4.19 |
| Fe(OH)3 |
3.8×10-38 |
2.53 |
2.94 |
| Ni(OH)2 |
1.6×10-14 |
7.60 |
9.75 |
回答下列问题:
(1)根据表数据判断步骤②依次析出沉淀Ⅱ 和沉淀Ⅲ (填化学式),则pH1 pH2(填填“>”、“=”或“<”),控制两种沉淀析出可利用 。
A.pH试纸 B.石蕊指示剂 C.pH计
(2)已知溶解度:NiC2O4>NiC2O4•H2O>NiC2O4•2H2O,则反应③的化学方程式是 .第③步反应后,过滤沉淀时需要的玻璃仪器有 .若过滤时发现滤液中有少量浑浊,从实验操作的角度给出两种可能的原因 、 。
(3)④中阳极反应产生的气体E为 ,验证该气体的试剂为 。
(4)试写出反应⑥的离子方程式_____________________________________________
25 ℃时,关于浓度均为0.2 mol/L的Na2CO3和NaHCO3溶液的说法不正确的是( )
| A.两溶液中均存在电离平衡和水解平衡 |
| B.两溶液分别加水稀释后,pH和KW均减小 |
| C.两溶液中均存在c(OH-)+2c(CO32—)+c(HCO3—)=c(Na+)+c(H+) |
| D.c(OH-)前者大于后者 |
A、B、C、D分别为NH4HSO4、Ba(OH)2、AlCl3、Na2CO3 4种物质中的1种,溶于水均完全电离,现进行如下实验:
①足量A溶液与B溶液混合共热可生成沉淀甲和刺激性气味气体;
②少量A溶液与C溶液混合可生成沉淀乙;
③A溶液与B溶液均可溶解沉淀乙,但都不能溶解沉淀甲。
请回答:
(1)A的化学式为________;室温时,将pH相等的A溶液与D溶液分别稀释10倍,pH分别变为a和b,则a________b(填“>”“=”或“<”)。
(2)加热蒸干C溶液并灼烧,最后所得固体为________(填化学式)。
(3)C溶液与D溶液反应的离子方程式为__________________________________________
(4)向B溶液中逐滴加入等体积、等物质的量浓度的NaOH溶液,滴加过程中水的电离平衡将________(填“正向”“不”或“逆向”)移动;最终所得溶液中各离子浓度由大到小的顺序为________________________________________________________________________。
(5)已知沉淀甲的Ksp=x。将0.03 mol·L-1的A溶液与0.01 mol·L-1的B溶液等体积混合,混合溶液中酸根离子的浓度为________(用含x的代数式表示,混合后溶液体积变化忽略不计)。
工业上将制取重铬酸钾(K2Cr2O7)和铬酸酐(CrO3)的剩余废渣称为铬渣,其成分为SiO2、Al2O3、MgO、Fe2O3、CrO3、K2Cr2O7等。
已知:
①重铬酸钾和铬酸酐都易溶于水,这是造成铬污染的主要原因,它们都是强氧化剂,铬酸酐溶于水呈酸性;
②+6价铬易被人体吸收,可致癌;+3价铬不易被人体吸收,毒性小。
③下表为一些金属氢氧化物沉淀的pH参照数据。
| 物质 |
开始沉淀 |
完全沉淀 |
| Fe(OH)3 |
2.7 |
3.7 |
| Al(OH)3 |
3.7 |
4.7 |
| Cr(OH)3 |
4.7 |
a |
| Fe(OH)2 |
7.6 |
9.6 |
| Mg(OH)2 |
9.6 |
11.1 |
回答下列处理铬渣、消除铬污染的有关问题:
(1)将铬渣用稀硫酸浸取、过滤,在浸出液中加入适量的绿矾(FeSO4·7H2O),加入绿矾的目的是_____________________________________________
(2)再向浸出液中缓慢加入烧碱,至pH刚好达到4.7,过滤,所得沉淀的化学式是____________________________________________________________;
常温下,Cr(OH)3的溶度积Ksp=10-32,要使Cr3+完全沉淀[c(Cr3+)降至10-5 mol·L-1视为沉淀完全],溶液的pH应调于a=________。
(3)向(2)中得到的滤液中加入硫酸,调节至呈强酸性,所得的溶液是含____________________溶质的溶液。
常温下,取pH=2的两种二元酸H2A与H2B各1 mL,分别加水稀释,测得pH变化与加水稀释倍数有如图所示变化,则下列有关叙述正确的是( )
A.H2A为二元弱酸
B.PH=4的NaHA水溶液中离子浓度大小为c(Na+)>c(HA-)>c(A2-)>c(H2A)>c(OH-)
C.含NaHA、NaHB的混合溶液中,离子浓度大小为c(Na+)=c(A2-)+c(HB-)+c(B2-)
D.Na2B的水溶液中,离子浓度大小为c(Na+)>c(B2-)>c(OH-)>c(H+)
在常温下,下列有关溶液中微粒的物质的量浓度关系正确的是( )。
A.1 L 0.1 mol·L-1(NH4)2Fe(SO4)2·6H2O的溶液中:c(NH4+)+c(Fe2+)+c(H+)=c(OH-)+c(SO42-)
B.0.1 mol·L-1 NH4HS溶液中:c(NH4+)<c(HS-)+c(H2S)+c(S2-)
C.0.1 mol·L-1 pH为4的NaHA溶液中:c(HA-)>c(H2A)>c(A2-)
D.等浓度的碳酸钠和碳酸氢钠溶液混合后的溶液中:2c(OH-)+c(CO32-)=c(HCO3-)+3c(H2CO3)+2c(H+)
下列有关溶液中微粒浓度关系的叙述正确的是( )。
| A.向0.1 mol·L-1NH4Cl溶液中通入一定量氨气后:c(Cl-)>c(NH4+)>c(OH-)>c(H+) |
| B.溶有等物质的量NaClO、NaHCO3的溶液中:c(HClO)+c(ClO-)=c(HCO3-)+c(H2CO3)+c(CO32-) |
| C.向CH3COONa溶液中滴加稀盐酸至中性,所得溶液中:c(Cl-)>c(Na+)>c(CH3COOH) |
| D.等物质的量浓度CH3COOH溶液和CH3COONa溶液等体积混合,所得溶液中:c(CH3COOH)+2c(OH-)=2c(H+)+c(CH3COO-) |
(1)pH=13的CH3COONa溶液加水稀释100倍后,pH________11(填“>”“=”或“<”)原因是______________________________________________(用离子方程式和必要的文字说明);pH相等的NaOH溶液与CH3COONa溶液,分别加热到相同的温度后CH3COONa溶液的pH________NaOH溶液的pH(填“>”“=”或“<”);
(2)pH相等时,①NH4Cl ②(NH4)2SO4 ③NH4HSO4三种溶液中c(NH4+)由大到小的顺序为________;
(3)等体积、等浓度的氢氧化钠与醋酸混合后溶液呈________性,溶液中c(Na+)________c(CH3COO-)(填“>”“=”或“<”);pH=13的氢氧化钠与pH=1的醋酸等体积混合后溶液呈________性,溶液中c(Na+)________c(CH3COO-)(填“>”“=”或“<”);
(4)将物质的量浓度相同的盐酸与氨水混合后,溶液中的c(NH4+)=c(Cl-),则混合后溶液呈________性,盐酸的体积________氨水的体积(填“>”“=”或“<”);
(5)NaHSO4在水中的电离方程式为NaHSO4=Na++H++SO42—。该溶液中c(H+)_________________________c(OH-)+c(SO42—)(填“>”“=”或“<”)。
试题篮
()