孔雀石主要含Cu2(OH)2CO3,还含少量铁的化合物和硅的化合物。以孔雀石为原料可制备CuCl2·3H2O及纯碱,流程如图所示。
已知:溶液A只含Cu2+、Fe2+、Fe3+三种金属离子,且三种离子沉淀时的pH如表所示。回答下列问题:
| 金属离子 |
Fe3+ |
Fe2+ |
Cu2+ |
|
| pH |
氢氧化物开始沉淀 |
1.9 |
7.0 |
4.7 |
| 氢氧化物完全沉淀 |
3.2 |
9.0 |
6.7 |
(1)图中“试剂1”为________。
(2)加入CuO的作用是调节溶液pH,则pH的范围为________。
(3)气体E、F与饱和食盐水作用生成H和G时,E和F应按一定先后顺序通入饱和食盐水中。其中,应先通入的气体是________(填代号及对应物质的化学式)。
(4)由溶液C获得CuCl2·3H2O,需要经过__________、________、过滤等操作。
(5)已知:常温下Cu(OH)2的Ksp=2×10-20。计算Cu2++2H2O Cu(OH)2+2H+的平衡常数为________。
Cu(OH)2+2H+的平衡常数为________。
下列各溶液中,微粒的物质的量浓度关系表述正确的是( )
| A.0.1 mol·L-1 Na2CO3溶液中:c(Na+)=c(HCO3—)+c(H2CO3)+2c(CO32—) |
| B.常温下,pH=4的醋酸与pH=10的NaOH溶液等体积混合后pH<7 |
| C.将0.2 mol·L-1 NaA溶液和0.1 mol·L-1盐酸溶液等体积混合所得碱性溶液中:c(Na+)+c(H+)=c(A-)+c(Cl-) |
| D.pH=12的Ba(OH)2溶液和pH=12的Na2CO3溶液中,水电离的c(H+)相等 |
无水氯化铝是一种重要的催化剂,工业上由Al2O3制备无水氯化铝的反应为2Al2O3(s)+6Cl2(g) 4AlCl3(g)+3O2(g) ΔH>0。下列分析错误的是( )
4AlCl3(g)+3O2(g) ΔH>0。下列分析错误的是( )
| A.增大反应体系的压强,反应速率加快 |
| B.加入碳粉,平衡向右移动,原因是碳与O2反应,降低了生成物的浓度且放出热量 |
| C.电解熔融的Al2O3和AlCl3均能得到单质铝 |
| D.将AlCl3·6H2O在氯化氢气流中加热,也可制得无水氯化铝 |
二元弱酸是分步电离的,25时碳酸和草酸的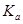 如下表:
如下表:
| H2CO3 |
Ka1=4.3×10-7 |
H2C2O4 |
Ka1=5.6×10-2 |
| Ka2=5.6×10-11 |
Ka2=5.42×10-5 |
(1)设有下列四种溶液:
A.0.1 mol/L的Na2C2O4溶液 B.0.1 mol/L的NaHC2O4溶液
C.0.1 mol/L的Na2CO3溶液 D.0.1 mol/L的NaHCO3溶液
其中,c(H+)最大的是_________,c(OH-)最大的是_________ 。
(2)某化学实验兴趣小组同学向用大理石和稀盐酸制备CO2后残留液中滴加碳酸钠溶液,在溶液中插人pH传感器,测得pH变化曲线如图所示。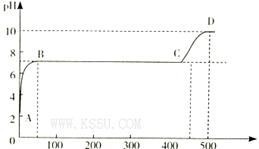
刚开始滴人碳酸钠溶液时发生反应的离子方程式为_________,BC段发生反应的离子方程式为_____,D点时混合溶液中由水电离产生的c(H+)="_________" mol/L。
铝灰的回收利用方法很多,现用含有Al2O3,SiO2和少量FeO xFe2O3的铝灰制备Al2(S04)3
xFe2O3的铝灰制备Al2(S04)3 18H2O,工艺流程如下:
18H2O,工艺流程如下:
请回答下列问题:
(1)加入过量稀H2SO4溶解Al2O3的离子方程式是______________。
(2)流程中加人的KMnO4也可用H2O2代替,若用H2O2发生反应的化学方程式为_______________。
(3)已知:浓度均为O.1mol/L的金属阳离子,生成氢氧化物沉淀的pH如下表:
步骤③的目的是__________________________________________________________;若在该浓度下除去铁的化合物,调节pH的最大范围是___________。
(4)已知 当pH=2时,Fe3+开始沉淀的浓度为_______________。
当pH=2时,Fe3+开始沉淀的浓度为_______________。
(5)操作④发生反应的离子方程式为__________________________________________;为了验证该操作所得固体中确实含有MnO2,可选用的试剂是_________或_________。
(6)操作⑤“一系列操作",下列仪器中不需用的是___________(填序号)。
| A.蒸发皿 | B.坩埚 | C.玻璃棒 | D.酒精灯E.漏斗 |
运用化学反应原理研究NH3的性质具有重要意义。请回答下列问题:
(1)氨气、空气可以构成燃料电池.其电池反应原理为4NH3+3O2=2N2+6H2O。则电解质溶液应该显 (填“酸性”“中性”或“碱性”).正极的电极反应式为 。
(2)25℃时.将amol·L—1的氨水与0.1mol·L—1的盐酸等体积混合。
①当溶液中离子浓度关系满足c(NH4+)>c(Cl-))时.则反应的情况可能为 。
A.盐酸不足.氨水剩余 B.氨水与盐酸恰好完全反应 C.盐酸过量
②当溶液中c(NH4+)=c(Cl-))时.用含“a”的代数式表示NH3·H2O的电离平衡常数Kb=______________.
(3)在0.5L恒容密闭容器中,一定量的N2与H2进行反应:N2(g)+3H2(g) 2NH3(g) ∆H=bkJ/mol,其化学平衡常数K与温度的关系如下:
2NH3(g) ∆H=bkJ/mol,其化学平衡常数K与温度的关系如下:
| 温度/℃ |
200 |
300 |
400 |
| K |
1.0 |
0.86 |
0.5 |
①写出该反应的化学平衡常数的表达式:__________,b________(填“大于”“小于”或“等于”)0
②400℃时,测得某时刻氨气、氮气、氢气的物质的量分别为3mol、2mol、1mol时,此时刻该反应的v正(N2)_________(填“大于”“小于”或“等于”)v逆(N2).
(4)已知:①4NH3(g)+3O2(g)=2N2(g)+6H2O(g) ∆H="-1266.8KJ/mol" ;②N2(g)+O2(g)=2NO(g) ∆H=+180.5KJ/mol,写出氨高温催化氧化的热化学方程式: 。
某研究性学习小组为了证明某酸HmA是强酸还是弱酸,设计了如下实验方案,请回答有关问题:
(1)当m=l时,测定0.1 mol/L HA的pH值,若测得0.1mol/L HA的pH=2,说明HA为__________酸(填“强”、“弱”)向此溶液中加入稀NaOH溶液,使其恰好完全反应,所得溶液pH_________7(填“>”“<”“=”),用离子方程式表示其原因__________.
(2)取少量NamA固体溶于蒸馏水,向所得溶液中滴加2滴石蕊试液,若溶液由无色变成蓝色,证明HmA是_______酸(填“强”、“弱”)。若某浓度的NamA溶液pH=9,则该溶液中水电离的c(OH-)=_________mol/L.
(3)室温下,将pH=2的酸HmA和pH=12的碱B(OH)n等体积混合,测得混合液的pH=10,若生成的正盐中只有一种离子能水解。则该离子水解的离子方程式为_________________________;若m、n都为1,所得混合液中各离子的物质的量浓度由大到小的顺序是____________。
(4)现有相同浓度的HA1、HA2两种溶液、蒸馏水、常见指示剂(如石蕊、酚酞)、pH试纸以及常用的实验仪器,有两位同学进行试验:一位同学取少量HA1溶液,滴加2滴石蕊试液,试液变红。微热,观察发现溶液红色加深,推断HA1为________ 酸(填“强”、“弱”)。另一位同学取少量HA2溶液,测定其pH。然后将溶液稀释100倍,再测其pH。对比两次测定的pH相差2,据此推断HA2为__________酸(填“强”、“弱”)。
许多硫的含氧酸盐在医药、化工等方面有着重要的用途。
(1)重晶石(BaSO4)常做胃肠道造影剂。已知:常温下,Ksp(BaSO4)=1.1×10-10。向BaSO4悬浊液中加入硫酸,当溶液的pH=2时,溶液中c(Ba2+)= ;
(2)硫酸亚铁铵晶体[(NH4)2Fe(SO4)2·6H2O]常做分析剂。等物质的量浓度的四种稀溶液:
a.(NH4)2Fe(SO4)2 b.NH4HSO4 c.(NH4)2SO4 d.(NH4)2SO3
其中c(NH4+)由大到小的顺序为 (填选项字母);
(3)过二硫酸钾(K2S2O8)常做强氧化剂,Na2S2O3常做还原剂。
①K2S2O8溶液与酸性MnSO4溶液混合,在催化剂作用下,可以观察到溶液变为紫色,该反应的离子方程式为 ;
②样品中K2S2O8的含量可用碘量法测定。操作步骤为称取0.3000 g样品于碘量瓶中,加50 mL水溶解;加入4.000 g KI固体(稍过量),振荡使其充分反应;加入适量醋酸溶液酸化,以 为指示剂,用0.1000 mol·L-1 Na2S2O3标准液滴定至终点(已知:I2+2S2O32-= 2I-+S4O62-)。重复2次,测得平均消耗标准液21.00 mL。该样品中K2S2O8的质量分数为(杂质不参加反应) _(结果保留三位有效数字)。
下列有关物质浓度关系的描述,正确的是 ( )。
| A.25 ℃时,NaB溶液的pH=8,c(Na+)-c(B-)=9.9×10-7mol·L-1 |
| B.25 ℃时,向0.1 mol·L-1NH4HSO4溶液中滴加NaOH溶液至中性:c(Na+)>c(NH4+)>c(SO42—)>c(OH-)=c(H+) |
| C.0.1 mol·L-1NaHCO3溶液中:c(OH-)+2c(CO32—)=c(H+)+c(H2CO3) |
| D.同温下,pH相同时,溶液物质的量浓度:c(CH3COONa)>c(NaHCO3)>c(C6H5ONa)>c(Na2CO3) |
下列各溶液中,微粒的物质的量浓度关系表述正确的是 ( )。
| A.0.1 mol·L-1 Na2CO3溶液中:c(Na+)=c(HCO3—)+c(H2CO3)+2c(CO32—) |
| B.常温下,pH=4的醋酸与pH=10的NaOH溶液等体积混合后pH<7 |
| C.将0.2 mol·L-1 NaA溶液和0.1 mol·L-1盐酸等体积混合所得碱性溶液中:c(Na+)+c(H+)=c(A-)+c(Cl-) |
| D.pH=12的Ba(OH)2溶液和pH=12的Na2CO3溶液中,水电离的c(H+)相等 |
某二元酸(化学式用H2B表示)在水中的电离方程式是H2B===H++HB-;HB- H++B2-。回答下列问题。
H++B2-。回答下列问题。
(1)Na2B溶液显_____(填“酸性”、“中性”或“碱性”),理由是_______(用离子方程式表示)。
(2)在0.1 mol·L-1的Na2B溶液中,下列粒子浓度关系式正确的是____。
A.c(B2-)+c(HB-)+c(H2B)=0.1 mol·L-1
B.c(Na+)+c(OH-)=c(H+)+c(HB-)
C.c(Na+)+c(H+)=c(OH-)+c(HB-)+2c(B2-)
D.c(Na+)=2c(B2-)+2c(HB-)
(3)已知0.1 mol·L-1 NaHB溶液的pH=2,则0.1 mol·L-1 H2B溶液中的氢离子的物质的量浓度可能____0.11 mol·L-1(填“<”、“>”或“=”),理由是_____。
(4)0.1 mol·L-1 NaHB溶液中各种离子浓度由大到小的顺序是_______。
在常温下,下列有关溶液中微粒的物质的量浓度关系正确的是
A.1L0.1mol·L-1(NH4)2Fe(SO4)2·6H2O的溶液中:c(NH4+)+c(Fe2+)+c(H+)=c(OH—)+c (SO42—)
B.0.1 mol·L-1 NH4HS溶液中:c(NH4+)<c(HS-)+c(H2S)+c(S2-)
C.0.1mol·L-1pH为4的NaHA溶液中:c(HA-)>c(H2A)>c(A2-)
D.等浓度的碳酸钠和碳酸氢钠溶液混合后的溶液中:c(OH-)+c(CO32-)=c(HCO3-)+c(H2CO3)+c(H+)
下列有关溶液中粒子浓度的关系式中,正确的是( )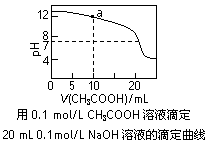
A.pH相同的①CH3COONa、②NaHCO3、③Na2CO3三份溶液中的c(Na+):③>②>①
B.0.1mol·L-1某二元弱酸强碱盐NaHA溶液中: c(Na+)=2c(A2-)+c(HA-)+c(H2A)
C.图中pH=7时:c(Na+)>c(CH3COO-) >c(OH-)=c(H+)
D.图中a点溶液中各离子浓度的关系是:c(OH-)=c(H+)+c(CH3COO-)+2c(CH3COOH)
金属镁及其化合物不仅在国防上有重要应用,在化学研究中也有广泛应用。
(1)某同学研究反应速率时用如下方法:取一段镁条,用砂纸擦去表面的氧化膜,使足量镁条与一定量盐酸反应生成H2的量与反应时间的关系曲线如图所示。镁与盐酸反应的离子方程式为 ;在前4min内,镁条与盐酸的反应速率逐渐加快,在4 min之后,反应速率逐渐减慢,请简述其原因:_____________。
(2)向少量的Mg(OH)2悬浊液中加入适量的饱和氯化铵溶液,固体完全溶解,写出NH4Cl饱和溶液使Mg(OH)2悬浊液溶解的离子方程式 。
(3)Mg Al可形成原电池:
| 编号 |
电极材料 |
电解质溶液 |
电子流动方向 |
| 1 |
Mg Al |
稀盐酸 |
Mg流向Al |
| 2 |
Mg Al |
NaOH溶液 |
|
根据上表中的实验现象完成下列问题:
①实验1中Mg为 极;
②实验2中电子流动方向 ,Al为 极,为什么? 。
试题篮
()