下列判断正确的是( )
A.同温下,HF比HClO易电离,则NaF溶液的pH比NaClO溶液的pH大
B.常温下,BaSO4在饱和Na2SO4溶液中的Ksp比在纯水中的Ksp小
C.常温下,0.4 mol•L-1 HA溶液和0.2 mol•L-1NaOH溶液等体积混合后的pH等于3,则混合溶液中粒子浓度大小关系:c(A-)>c(Na+)>c(HA)>c(H+)>c(OH-)
D.用铂电极电解食盐水,一段时间后两极产生气体体积比为3:2(同条件下),为将电解液
恢复原状,则只需向电解液中通入一定量的HCl气体
对于等物质的量浓度的Na2CO3和NaHCO3溶液,下列说法不正确的是( )
| A.分别升高温度,两种溶液的pH均减小 |
| B.相同温度下两种溶液的pH:Na2CO3> NaHCO3 |
| C.分别加入少量NaOH,两溶液中c(CO32-)均增大 |
| D.两溶液均存在c(Na+) + c(H+)=c(OH-) + c(HCO3-) + 2c(CO32-) |
某温度下,向一定体积0.1mol/L醋酸溶液中逐滴加入等浓度的NaOH溶液,溶液中pOH(pOH=-lg[OH-])与pH的变化关系如图所示,则( )
| A.M点所示溶液导电能力强于Q点 |
| B.N点所示溶液中c(CH3COO-)>c(Na+) |
| C.M点和N点所示溶液中水的电离程度相同 |
| D.Q点消耗NaOH溶液的体积等于醋酸溶液的体积 |
下列有关电解质溶液中微粒浓度关系不正确的是
A.0.lmol/LpH=4的NaHA溶液中: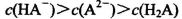 |
B.1mol/L的NaHCO3溶液中: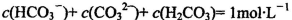 |
C.常温下,pH=7的NH4Cl与氨水的混合溶液中: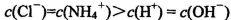 |
D.等体积、等物质的量浓度的NaX和弱酸HX的混合溶液中: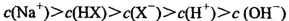 |
酸性条件下,锡在水溶液中有Sn2+、Sn4+两种主要存在形式。SnSO4是一种重要的硫酸盐,广泛应用于镀锡工业,其制备路线如下:
回答下列问题:
(1)SnCl2用盐酸而不用水直接溶解的原因是
加入锡粉的作用是
(2)反应I生成的沉淀为SnO,写出该反应的化学方程式:
(3)检验沉淀已经“洗涤”干净的操作是:
(4)反应Ⅱ硫酸的作用之一是控制溶液的pH。若溶液中c(Sn2+)=1.0mol·L—1,则室温下应控制溶液pH 。(已知:Ksp[Sn(OH)2]=1.0×10—26)
(5)酸性条件下,SnSO4还可用作双氧水的去除剂,试写出所发生反应的离子方程式:
。
(6)潮湿环境中,镀锡铜即使锡层破损也能防止形成铜绿,请结合有关的原理解释其原因:
。
常温下,用 0.10 mol·L-1 NaOH溶液分别滴定20.00 mL 0.10 mol·L-1 HCl溶液和20.00 mL 0.10 mol·L-1 CH3COOH溶液,得到2条滴定曲线,如下图所示,则下列说法正确的是( )

图1 图2
| A.图2是滴定盐酸的曲线 |
| B.a与b的关系是:a<b |
| C.E点对应离子浓度由大到小的顺序为: c(CH3COO-)> c(Na+)> c(H+)> c(OH-) |
| D.这两次滴定都可以用甲基橙作为指示剂 |
有X、Y、Z、W四种物质的水溶液,它们分别是Na2CO3、NaOH、CH3COOH和NaCl中的一种。已知X、Y两溶液中水的电离程度相同,X、Z两溶液的pH相同,请回答下列问题:
(1)X是 ,Z是 ;
(2)Z、W两溶液中水的电离程度由大到小的顺序为 (用化学式表示);
(3)写出Z溶液与过量Y溶液反应的离子方程式 ;
(4)X、Y两溶液恰好完全反应后,溶液中各离子浓度由大到小的顺序是
。
下列说法正确的是( )
A.0.01mol/L的Na2HPO4溶液中存在如下的平衡:HPO42- H++PO43-,加水稀释,使溶液中的HPO42-、H+、PO43-的浓度均减小 H++PO43-,加水稀释,使溶液中的HPO42-、H+、PO43-的浓度均减小 |
| B.饱和NH4Cl溶液中:c(H+)+c(Cl-)=c(NH4+)+2c(NH3•H2O)+c(OH-) |
| C.常温下,0.01mol/L的 HA和BOH两种溶液,其pH值分别为3和12,将两溶液等体积混和后,所得溶液的pH≦7 |
| D.在NH4HSO3溶液中,c(NH4+)= c(SO32-)+ c(HSO3-)+ c(H2SO3) |
室温下,将一元酸HA的溶液和KOH溶液等体积混合(忽略体积变化),实验数据如下表:
| 实验编号 |
起始浓度/(mol·L-1) |
反应后溶液的pH |
|
| c(HA) |
c(KOH) |
||
| ① |
0.1 |
0.1 |
9 |
| ② |
x |
0.2 |
7 |
下列判断不正确的是( )
A.实验①反应后的溶液中:c(K+) > c(A—) > c(OH—) > c(H+)
B.实验①反应后的溶液中:c(OH—) = c(K+) — c(A—) = mol/L
mol/L
C.实验②反应后的溶液中:c(A—) + c(HA) > 0.1 mol/L
D.实验②反应后的溶液中:c(K+) = c(A—) > c(OH—) = c(H+)
下列有关说法正确的是 ( )
| A.25℃时,0.1mol·L-1的三种溶液的pH关系为:pH(NaHCO3) > pH(Na2CO3) >pH(CH3COONa) |
| B.25℃时,pH=5的CH3COOH溶液和pH=5的NH4Cl溶液,c(H+)相等 |
| C.25℃时,BaCO3在纯水中的KSP比在Na2CO3溶液中的KSP大。 |
| D.NaHCO3和Na2CO3混合溶液中,一定有c(Na+)+c(H+)=c(OH-)+c(HCO3-)+2c(CO32-) |
(1)①pH= a的CH3COOH溶液稀释100倍后所得溶液pH a +2(填“>”或“<”)
②0.01mol/LCH3COOH溶液的pH 2(填“>”或“<”);
③0.1mol/LCH3COONa溶液的pH 7(填“>”或“<”);
(2)某固体是由Na2CO3、NaOH、MgCl2、AlCl3、BaCl2、Fe2(SO4)3和(NH4)2SO4中的两种混合而成。取该固体溶于水得到无色澄清溶液,向该溶液中加入稀硫酸,有白色沉淀生成,继续加入稀硫酸,沉淀又完全消失,且整个过程中无气体产生。则 原固体中含有物质有 和 。(写化学式)
常温下,用0.10 mol·L-1 KOH溶液滴定10.00 mL 0.10 mol·L-1H2C2O4(二元弱酸)溶液所得滴定曲线如图(混合溶液的体积可看成混合前溶液的体积之和)。下列说法正确的是( )

| A.点①所示溶液中: c(H+)/c(OH—)=1012 |
| B.点②所示溶液中:c(K+)+c(H+)=c(HC2O4—)+c(C2O42-)+c(OH—) |
| C.点③所示溶液中:c(K+)>c(HC2O4—)>c(H2C2O4)>c(C2O42-) |
| D.点④所示溶液中:c(K+)+ c(H2C2O4)+ c(HC2O4—) +c(C2O42-)=0.10mol·L-1 |
已知0.1mol·L-1的二元酸H2A溶液的pH=4.0,则下列说法正确的是( )
A.在Na2A、NaHA两溶液中,离子种类不相同
B.在溶质物质的量相等的Na2A、NaHA两溶液中,阴离子总数相等
C.在Na2A溶液中一定有:c(Na+)>c(A2-)>c(H+)>c(OH-)
D.在NaHA溶液中一定有:c(Na+)+c(H+)=c(HA-)+c(OH-)+2c(A2-)
对于0.1mol·L-1 Na2SO3溶液,正确的是( )
| A.升高温度,溶液的pH降低 |
| B.c(Na+)=2c(SO32—)+ c(HSO3—)+ c(H2SO3) |
| C.c(Na+) + c(H+) = 2c(SO32—)+ 2c(HSO3—) + c(OH—) |
| D.加入少量NaOH固体,c(SO32—)与c(Na+)均增大 |
常温下, 浓度均为0. 1 mol/L的6种溶液的pH如下表:
| 序号 |
a |
b |
c |
d |
e |
f |
| 溶质 |
CH3COONa |
NaHCO3 |
Na2CO3 |
NaClO |
NaCN |
NaAlO2 |
| pH |
8. 8 |
9. 7 |
11. 6 |
10. 3 |
11. 1 |
11. 3 |
(1)上述溶液中的阴离子结合H+能力最弱的为 。(填阴离子化学式)
(2)NaAlO2溶液呈碱性的原因是 (用离子方程式表示)。将溶液加热蒸干最后得到的固体产物是 ;
(3)结合表中数据分析, 与0. 1 mol/L的CH3COONa溶液中水的电离程度相同的有 (填字母代号)。
A.pH="8." 8的NaOH溶液 B. pH="5." 2的NH4Cl溶液 C.pH="5." 2的盐酸
D. 0. 1 mol/L的NaCN溶液 E.pH="8." 8的Na2CO3溶液
(4)将浓度均为0. 1 mol/L的b、c等体积混合, 所得溶液中各离子浓度关系正确的有 。
A.c(Na+)= c(CO32-) +c(HCO3-) +c(H2CO3)
B. 2c(Na+)=3c(CO32-) +3c(HCO3-) +3c(H2CO3)
C. c(OH-)= c(H+) +c(HCO3-) +2c(H2CO3)
D. c(Na+) +c(H+) = 2c(CO32-) +c(HCO3-) +c(OH-)
E. c(Na+)>c(HCO3-)> c(CO32-) > c(OH-)> c(H+)
F. c(Na+)> c(CO32-) > c(HCO3-) > c(H+)> c(OH-)
(5)0.2 mol/LHCl与0.1 mol/L NaAlO2溶液等体积混合溶液后离子浓度顺序为 。
试题篮
()