为了配制 的浓度与Cl-的浓度比为1∶1的溶液,可在NH4Cl的溶液中加入( )
的浓度与Cl-的浓度比为1∶1的溶液,可在NH4Cl的溶液中加入( )
①适量的HCl ②适量的NaCl ③适量的氨水 ④适量的NaOH
| A.①② | B.③ | C.③④ | D.④ |
下列反应不属于水解反应或水解方程式不正确的是( )
①HCl+H2O H3O++Cl-
H3O++Cl-
②AlCl3+3H2O====Al(OH)3+3HCl
③Na2CO3+2H2O H2CO3+2NaOH
H2CO3+2NaOH
④碳酸氢钠溶液: +H2O
+H2O
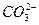 +H3O+
+H3O+
⑤NH4Cl溶于D2O中: +D2O
+D2O NH3·D2O+H+
NH3·D2O+H+
| A.①②③④ | B.①②③ |
| C.②③⑤ | D.全部 |
实验室在配制硫酸铁溶液时,先把硫酸铁晶体溶解在稀硫酸中,再加水稀释到所需的浓度,这样操作的目的是( )
| A.提高硫酸铁的溶解度 | B.防止硫酸铁分解 |
| C.降低溶液的pH | D.抑制硫酸铁水解 |
把0.2 mol·L-1NH4Cl溶液与0.1 mol·L-1NaOH溶液等体积混合后溶液中下列微粒的物质的量浓度的关系正确的是( )
A.c( )=c(Na+)=c(OH-)>c(NH3·H2O) )=c(Na+)=c(OH-)>c(NH3·H2O) |
B.c( )=c(Na+)>c(NH3·H2O)>c(OH-) )=c(Na+)>c(NH3·H2O)>c(OH-) |
C.c( )>c(Na+)>c(OH-)>c(NH3·H2O) )>c(Na+)>c(OH-)>c(NH3·H2O) |
D.c( )>c(Na+)>c(NH3·H2O)>c(OH-) )>c(Na+)>c(NH3·H2O)>c(OH-) |
在0.1 mol·L-1Na2CO3溶液中,各种微粒之间存在下列关系,其中不正确的是( )
A.c(Na+)+c(H+)=2c( )+c( )+c( )+c(OH-) )+c(OH-) |
B.c(Na+)=2[c( )+c( )+c( )+c(H2CO3)] )+c(H2CO3)] |
C.c(OH-)=c(H+)+c( )+2c(H2CO3) )+2c(H2CO3) |
D.c(Na+)=c( )=c(OH-)=c(H+) )=c(OH-)=c(H+) |
25 ℃时,在浓度均为1 mol·L-1的(NH4)2SO4、(NH4)2SO3、(NH4)2Fe(SO4)2三种溶液中,若测得其中c( )分别为a、b、c(单位为mol·L-1),则下列判断正确的是( )
)分别为a、b、c(单位为mol·L-1),则下列判断正确的是( )
| A.a="b=c" | B.c>a>b | C.b>a>c | D.a>c>b |
下列比较中,正确的是( )
| A.同温度同物质的量浓度时,HF比HCN易电离,则NaF溶液的pH比NaCN溶液大 |
| B.0.2 mol·L-1NH4Cl和0.1 mol·L-1NaOH溶液等体积混合后: c(  )>c(Cl-)>c(Na+)>c(OH-)>c(H+) )>c(Cl-)>c(Na+)>c(OH-)>c(H+) |
| C.物质的量浓度相等的H2S和NaHS混合溶液中: c(Na+)+c(H+)=c(S2-)+c(HS-)+c(OH-) |
D.同浓度的下列溶液中,①(NH4)2SO4、②NH4Cl、③CH3COONH4、④NH3·H2O;c( )由大到小的顺序是:①>②>③>④ )由大到小的顺序是:①>②>③>④ |
下列叙述正确的是( )
| A.在0.1 mol·L-1 CH3COONa溶液中,c(OH-)=c(CH3COOH)+c(H+) |
| B.把0.1 mol·L-1氨水和0.1 mol·L-1 HCl溶液充分反应后混合溶液pH="7" |
| C.在0.1 mol·L-1 NaHS溶液中,c(Na+)=2c(S2-)+c(HS-)+c(H2S) |
D.在0.1 mol·L-1的小苏打溶液中, 的电离程度大于 的电离程度大于 的水解程度 的水解程度 |
下列叙述正确的是( )
A.0.1 mol·L-1氨水中,c(OH-)=c(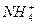 ) ) |
| B.0.1 mol·L-1NH4Cl溶液中,c(H+)=c(NH3·H2O)+c(OH-) |
C.0.1 mol·L-1NaHCO3溶液中,c(Na+)=2c( )+c( )+c( )+c(H2CO3) )+c(H2CO3) |
| D.0.02 mol·L-1盐酸与0.02 mol·L-1Ba(OH)2溶液等体积混合后,溶液的pH=13 |
为了说明盐类水解是吸热反应,现用醋酸钠进行实验,表明它在水解时是吸热反应,其中的实验方案正确的是( )
| A.将CH3COONa·3H2O晶体溶于水,温度降低 |
| B.醋酸钠水溶液的pH大于7 |
| C.醋酸钠溶液滴入酚酞是红色,加热后颜色变深 |
| D.醋酸钠溶液与浓硫酸微热,可逸出醋酸蒸气 |
试题篮
()