0.02mol·L—1的HCN溶液与0.02mol·L—1的NaCN溶液等体积混合,已知混合溶液中C(CN-)<C(Na+),则下列关系中,正确的是:
| A.C(Na+)>C(CN-)>C( H+)>C(OH-) |
| B.C(HCN)+C (CN-)=0.04mol·L-1 |
| C.C(CN-)>C(HCN) |
| D.C(Na+)+C(H+)= C(CN-)+C(OH-) |
用物质的量都是0.1mol的HCN和NaCN混合后配成1L溶液,已知溶液中的c(CN-)<c(Na+),下列关系式正确的是( )
| A.c(H+)>c(OH-) | B.c(HCN)<c(CN-) |
| C.c(CN-)+c(OH-)=0.1mol·L-1 | D.c(HCN)+c(CN-) =0.2mol·L—11 |
0.1 mol•L-1 KHS溶液中下列表达式不正确的是( )
| A.c(K +)+c(H+)= c(OH-)+ c(HS-)+2 c(S2-) | B.c(K+)> c(HS-)> c(OH-)> c(S2-)> c(H+) |
| C.c(HS-)+ c(S2-)+ c(H2S)=" 0.1" mol•L-1 | D.c(K+)> c(HS-)> c(OH-)> c(H2S)> c (H+) |
用酒精灯加热下列溶液,蒸干后灼烧,所得固体质量最大的是( )
| A.20 mL 2 mol/L FeCl3溶液 | B.40 mL 1 mol/L NaHCO3溶液 |
| C.20 mL 1 mol/L Na2SO3溶液 | D.40 mL 2 mol/L NH4HCO3溶液 |
下列有关0.1mol·L-1NaHCO3溶液中浓度关系式正确的是
| A.c(Na+)>c(HCO3-)>c(CO32-)>c(H+)>c(OH-) |
| B.c(Na+)> c(CO32-) > c(HCO3-) > c(OH-) >c(H+) |
| C.c(Na+)= c(HCO3-)+2 c(CO32-)+ c(H2CO3) |
| D.c(Na+)+ c(H+)= c(HCO3-)+2 c(CO32-)+ c(OH-) |
已知某酸H2B在水溶液中存在下列关系:
①H2B===H++HB-,②HB-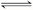 H++B2-.关于该酸对应的酸式盐NaHB的溶液,下列说法中,一定正确的是
H++B2-.关于该酸对应的酸式盐NaHB的溶液,下列说法中,一定正确的是
A.NaHB属于弱电解质
B.溶液中的离子浓度c(Na+)>c(HB-)>c(H+)>c(OH-)
C.c(Na+)=c(HB-)+c(B2-)+c(H2B)
D.NaHB和NaOH溶液反应的离子方程式为H++OH-===H2O
在体积均为1 L,pH均等于2的盐酸和醋酸溶液中,分别投入0.23 g Na,则下图中比较符合反应事实的曲线是( )
已知反应:BeCl2+Na2BeO2+2H2O===2NaCl+2Be(OH)2↓能完全进行,则下列推断正确的是( )
| A.Na2BeO2溶液的pH>7,将其蒸干并灼烧后得到的残留物为BeO |
| B.BeCl2溶液的pH<7,将其蒸干并灼烧后得到的残留物可能为Be(OH)2 |
| C.Be(OH)2既能溶于盐酸,又能溶于NaOH溶液 |
| D.BeCl2水溶液的导电性强,故BeCl2是离子化合物 |
下列各溶液中,微粒的物质的量浓度关系正确的是( )
A.10 mL 0.5 mol/L CH3COONa溶液与6 mL 1 mol/L盐酸混合:c(Cl-)>c(Na+)>c(H+)>c(OH-)
B.0.1 mol/L pH为4的NaHB溶液中:c(HB-)>c(H2B)>c(B2-)
C.在NaHA溶液中一定有:c(Na+)+c(H+)=c(HA-)+c(OH-)+c(A2-)
D.c(NH4+)相等的(NH4)2SO4溶液、(NH4)2CO3溶液和NH4Cl溶液:c[(NH4)2SO4]<c[(NH4)2CO3]<c(NH4Cl)
下列说法正确的是( )
| A.pH=12的NaOH溶液中,c(H+)=10-12 mol·L-1,稀释为原体积的10倍后c(H+)=mol·L-1=10-13mol·L-1 |
| B.pH=3的CH3COOH溶液与pH=11的NaOH溶液等体积混合后溶液因生成的CH3COONa水解,pH>7 |
| C.pH=3的HA酸溶液中c(H+)=10-3 mol·L-1,稀释为原体积的10倍后pH≤4 |
| D.pH=11和pH=13的NaOH溶液等体积混合后,溶液中的c(H+)=mol·L-1 |
今有室温下四种溶液,有关叙述不正确的是( )
| |
① |
② |
③ |
④ |
| pH |
11 |
11 |
3 |
3 |
| 溶液 |
氨水 |
氢氧化钠溶液 |
醋酸 |
盐酸 |
| A.①、②中分别加入适量的氯化铵晶体后,两溶液的pH均减小 |
| B.分别加水稀释10倍,四种溶液的pH:①>②>④>③ |
| C.①、④两溶液等体积混合,所得溶液中c(Cl-)>c(NH4+)>c(OH-)>c(H+) |
| D.VaL④与VbL②溶液混合后,若混合后溶液pH=4,则Va∶Vb=11 ∶9 |
25℃时,pH=13的氨水中由水电离出的c(H+)=a,pH=1的盐酸中由水电离出的c(H+)=b,0.2 mol·L-1盐酸与0.1 mol·L-1氢氧化钠溶液等体积混合后,由水电离出的c(H+)=c,则a、b、c的关系正确的是( )
| A.a>b=c | B.a=b=c |
| C.c>a=b | D.a>c>b |
常温下,用0.1000mol·L-1 NaOH溶液滴定20.00mL 0.1000mol·L-1 CH3COOH溶液,滴定曲线如下图。下列说法正确的是( )
| A.点①所示溶液中:[CH3COO-]+[OH-]=[CH3COOH]+[H+] |
| B.点②所示溶液中:[Na+]=[CH3COOH]+[CH3COO-] |
| C.点③所示溶液中:[Na+]>[OH-]>[CH3COO-]>[H+] |
| D.滴定过程中可能出现: |
[CH3COOH]>[CH3COO-]>[H+]>[Na+]>[OH-]
下列叙述中,不正确的是 ( )
| A.c(NH4+)相等的(NH4)2SO4、(NH4)2Fe(SO4)2和NH4Cl溶液中,溶质浓度大小关系是:c[(NH4)2Fe(SO4)2] < c[(NH4)2SO4] < c(NH4Cl) |
| B.10 mL 0.10 mol·L―1 CH3COOH溶液加入等物质的量的NaOH后,溶液中有 c(Na+)=c(CH3COO-)>c(OH-)=c(H+) |
| C.两种醋酸溶液的物质的量浓度分别为c1和c2,pH分别为a和(a+1),则有c1=10c2 |
| D.NaHCO3溶液中:c(H+) + c(H2CO3)=c(CO32-) + c(OH-) |
下列说法正确的是
| A.酸性溶液中水的电离程度一定比纯水的电离程度小 |
| B.室温下:pH=3的醋酸和pH=11的NaOH溶液等体积混合后,pH>7 |
| C.HA的酸性比HB的强,则Na A溶液的pH一定比NaB溶液的小 |
D.0.1mol/L Na2CO3溶液和0.1mol/L NaHSO4溶液等体积混合,溶液中c(Na+)> c(SO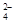 ) >c(HCO ) >c(HCO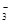 )> c(OH-)> c(H+) )> c(OH-)> c(H+) |
试题篮
()